题目内容
9.有E、Q、T、X、Z五种前四周期元素,原子序数E<Q<T<X<Z.E、Q、T三种元素的基态原子具有相同的能层和能级,且I1(E)<I1(T)<I1(Q),其中基态Q原子的2p轨道处于半充满状态,且QT2+与ET2互为等电子体.X为周期表前四周期中电负性最小的元素,Z的焰色为绿色.请回答下列问题(答题时如需表示具体元素,请用相应的元素符号):
(1)写出QT2+的电子式
 、基态Z原子的价层电子排布图
、基态Z原子的价层电子排布图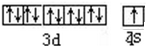 .从光谱的角度解释Z原子特征焰色产生原因:铜原子的外层电子在发生跃迁时会一定波长的光
.从光谱的角度解释Z原子特征焰色产生原因:铜原子的外层电子在发生跃迁时会一定波长的光(2)Q的简单氢化物极易溶于T的简单氢化物,其主要原因有这两种氢化物均为极性分子、相互之间能形成氢键等两种.
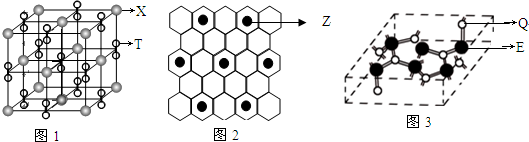
(3)化合物甲由T、X两元素组成,其晶胞如图1,物质乙由E、Z两种元素组成,其二维结构如图2,则甲的化学式为KO2.乙的一个晶胞中E原子有42个
(4)1993年哈佛大学科学家利用激光溅射技术成功研制由E、Q两元素组成的晶体材料丙,该晶胞如图3所示.分析表明这种晶体的硬度将超过目前世界上最硬的金刚石此空多余晶体,成为首屈一指的超硬新材料.
乙的晶体类型为原子晶体,E元素原子的杂化方式为sp3,其硬度超过金刚石的原因是C-N键的键长小于C-C键,键能大于C-C键.
分析 E、Q、T三种元素的基态原子具有相同的能层和能级,应位于周期表同一周期,基态Q原子的2p轨道处于半充满状态,则原子核外电子排布式为1s22s22p3,应为N元素,I1(E)<I1(T)<I1(Q),且原子序数E<Q<T,则T应为O元素,QT2+与ET2互为等电子体,则E应为C元素,NO2+与CO2的电子数都为22,X为周期表前四周期中电负性最小的元素,应为K元素,Z的焰色为绿色,则Z为Cu元素,结合元素对应的单质、化合物的性质以及元素周期律解答该题.
解答 解:依据分析可知:E为C、Q为N、T为O、X为K、Z为Cu,
(1)QT2+为NO2+,电子式为 ;Z为Cu元素,原子序数为29,位于周期表第四周期第ⅠB族,其价电子排布式为 3d104s1,则价电子排布图为
;Z为Cu元素,原子序数为29,位于周期表第四周期第ⅠB族,其价电子排布式为 3d104s1,则价电子排布图为 ;Cu元素的原子在接受火焰提供的能量时,其外层电子将会被激发到能量较高的激发态,处于激发态的外层电子不稳定,又要跃迁到能量较低的基态,同时释放一定波长的光;
;Cu元素的原子在接受火焰提供的能量时,其外层电子将会被激发到能量较高的激发态,处于激发态的外层电子不稳定,又要跃迁到能量较低的基态,同时释放一定波长的光;
故答案为: ;
;  ;1s22s22p63s23p63d104s1;铜原子的外层电子在发生跃迁时会一定波长的光;
;1s22s22p63s23p63d104s1;铜原子的外层电子在发生跃迁时会一定波长的光;
(2)Q的简单氢化物和T的简单氢化物分别为NH3、H2O,两种分子立体构型相似,都为极性分子,并且N、O元素的电负性较大,氢化物中存在氢键,两种原因导致氨气极易溶于水,
故答案为:这两种氢化物均为极性分子、相互之间能形成氢键;
(3)晶胞中K+位于晶胞的顶点和体心位置,平均1个晶胞含有K+的个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞中,由O元素构成的离子个数为:2×(12×$\frac{1}{4}$+1)=8,则甲的化学式为KO2;图2中乙的二维结构中含有7个Cu原子,在三维空间里,其原子数为7×6=42,即晶胞中含有42个Cu原子;
故答案为:KO2;42;
(4)乙由E、Q两元素组成,硬度超过金刚石,则乙为原子晶体,由于C-N键的键长小于C-C键,键能大于C-C键,则硬度超过金刚石;晶体中C原子与4个N原子成键,N原子与3个C原子成键,并用1个孤电子对,都为sp3杂化;
故答案为:原子晶体;sp3;C-N键的键长小于C-C键,键能大于C-C键.
点评 题考查较为综合,涉及电子式、电子排布式的书写、氢键、晶胞的计算及晶体的性质,题目难度中等,本题易错点为(4),注意杂化类型的判断.

| A. | 甲烷 | B. | 乙烯 | C. | 二硫化碳 | D. | 乙醇 |
| A. | 草酸与氢氧化钠溶液混合呈中性时,溶液中存在:c(Na+)=c(HC2O4-)+c(C2O42-) | |
| B. | NaHC2O4与NaClO溶液混合,反应的离子方程式为:HC2O4-+ClO-=HClO+C2O42- | |
| C. | (NH4)2C2O4溶液中:c(NH4+)=2 c(H2C2O4)+2 c(HC2O4-)+2 c(C2O42-) | |
| D. | 草酸使酸性KMnO4溶液褪色,离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O |
| A. | 甘氨酸与丙氨酸在一定条件下发生取代反应,最多可以获得四种二肽 | |
| B. | 煤的干馏得到的煤焦油中可以分离出苯及苯的同系物,也可以分离出丙烯等石油化工原料 | |
| C. | 用原子吸收光谱可以确定物质中含有哪些金属元素 | |
| D. | 淀粉、麦芽糖水解后的最终产物都是葡萄糖 |
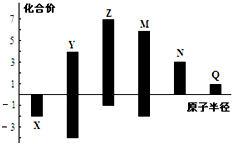 X、Y、Z、M、N、Q皆为短周期主族元素,其原子半径与主要化合价的关系如图所示,下列说法正确的是( )
X、Y、Z、M、N、Q皆为短周期主族元素,其原子半径与主要化合价的关系如图所示,下列说法正确的是( )| A. | 金属性:N>Q | |
| B. | 最高价氧化物对应水化物酸性:M>Y>N | |
| C. | 简单离子半径:Q>N>X | |
| D. | 原子序数:Z>M>Y>X |
| A. | 分子式为C4H8的有机物有3种同分异构体(不考虑立体异构) | |
| B. | 汽油、煤油、柴油、甘油结构相似,性质相似 | |
| C. | -C(CH3)3的系统命名为1,1-二甲基乙基 | |
| D. | 聚乙烯塑料老化是因为发生了加成反应 |
反应①O3?O2+[O]△H>0 平衡常数为K1;
反应②[O]+O3?2O2△H<0 平衡常数为K2;
总反应:2O3?3O2△H<0 平衡常数为K
下列叙述正确的是( )
| A. | 升高温度,K增大 | B. | K=K1+K2 | ||
| C. | 适当升温,可提高消毒效率 | D. | 压强增大,K2减小 |