题目内容
常温下,向20.00 mL 0.100 mol·L-1 CH3COONa溶液中逐滴加入0.100 0 mol·L-1盐酸,溶液的pH与所加盐酸体积的关系如下图所示(不考虑挥发)。下列说法正确的是( )
| A.点①所示溶液中:c(CH3COOH)=c(Cl-)>c(OH-)=c(H+) |
| B.点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH) |
| C.点③所示溶液中:c(CH3COOH)>c(Na+)>c(H+)>c(CH3COO-) |
| D.整个过程中可能出现:c(H+)+c(Na+)=c(CH3COOH)+c(CH3COO-) |
A
解析

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
某温度下,向一定体积0.1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH( pOH=-lgc(OH-) )与pH的变化关系如图所示,则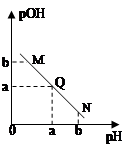
| A.N点所示溶液中c(H+) < c(OH-) |
| B.M点所示溶液导电能力强于Q点 |
| C.M点水的电离程度大于N点 |
| D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积 |
在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-离子浓度分别为A mol·L-1与B mol·L-1,则A和B的关系为
| A.A>B | B.A=10-4B | C.B=10-4A | D.A=B |
25℃时,浓度均为1 mol/L的AX、BX、AY、BY四种正盐溶液,AX溶液的pH=7且溶液中c(X-)=1 mol/L,BX溶液的pH=4,BY溶液的pH=6。下列说法正确的是( )
| A.AY溶液的pH小于7 |
| B.AY溶液的pH小于BY溶液的pH |
| C.稀释相同倍数,BX溶液的pH变化小于BY溶液 |
| D.电离平衡常数K(BOH)小于K(HY) |
下列叙述正确的是( )
A.浓度均为0.1 mol· 的CH3COOH和CH3COONa溶液等体积混合所得的溶液中: 的CH3COOH和CH3COONa溶液等体积混合所得的溶液中:c(CH3COOH)+c(CH3COO-)="0.2" mol·  |
B.0.1 mol· NaHCO3溶液中:c(Na+)=c(HC NaHCO3溶液中:c(Na+)=c(HC )+c(H2CO3)+2c(C )+c(H2CO3)+2c(C ) ) |
C.0.2 mol· HCl溶液与等体积的0.1 mol· HCl溶液与等体积的0.1 mol· NaOH溶液混合后,溶液的pH=1 NaOH溶液混合后,溶液的pH=1 |
D.0.1 mol· 氨水中滴入0.1 mol· 氨水中滴入0.1 mol· 盐酸至溶液呈中性时,混合溶液中:c(N 盐酸至溶液呈中性时,混合溶液中:c(N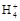 )=c(Cl-) )=c(Cl-) |
已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+。欲使平衡发生如图变化,可以采取的措施是( )
CH3COO-+H+。欲使平衡发生如图变化,可以采取的措施是( )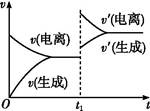
| A.加少量烧碱溶液 | B.升高温度 | C.加少量冰醋酸 | D.加水 |
常温时,将V1 mL c1 mol·L-1的氨水滴加到V2 mL c2 mol·L-1的盐酸中,下述结论中正确的是( )
| A.若混合溶液的pH=7,则c1V1>c2V2 |
B.若V1=V2,c1=c2,则混合液中c(N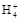 )=c(Cl-) )=c(Cl-) |
C.若混合液的pH=7,则混合液中c(N )>c(Cl-) )>c(Cl-) |
| D.若V1=V2,且混合液的pH<7,则一定有c1<c2 |