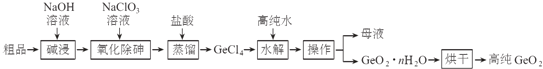
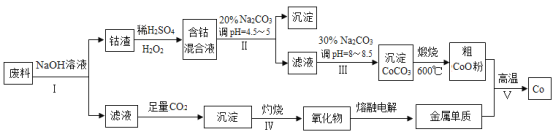
题目内容
【题目】根据下表回答下列有关问题.
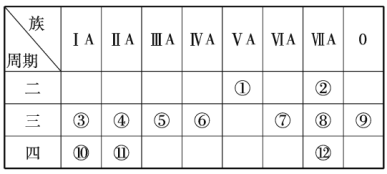
(1)写出下列元素符号:①______,⑥______,⑦______,______.
(2)这些元素中最活泼的金属元素是______(填元素符号,下同),最活泼的非金属元素是______,最不活泼的元素是______.
(3)这些元素的最高价氧化物对应的水化物中酸性最强的是______(填化学式,下同),碱性最强的是______,呈两性的氢氧化物是______,写出三者之间两两反应的化学方程式:______;______;______.
(4)这些元素(除0族元素外)中原子半径最小的是______(填元素符号,下同),原子半径最大的是______.
(5)在③与④中,单质的化学性质较活泼的是______(填元素符号),怎样用化学实验证明?______在⑧与中,单质的化学性质较活泼的是____________(填元素符号),怎样用化学实验证明?_____________________.
【答案】N Si S Ca K F Ar ![]()
![]()
![]()
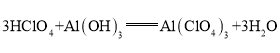
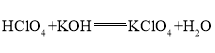
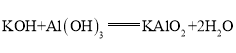 F K Na 将Na、Mg分别与冷水反应,
F K Na 将Na、Mg分别与冷水反应,![]() 跟冷水剧烈反应,放出氢气,Mg跟冷水不反应 Cl
跟冷水剧烈反应,放出氢气,Mg跟冷水不反应 Cl ![]() 将氯气通入溴化钠溶液中,溶液变为橙红色,发生的反应为
将氯气通入溴化钠溶液中,溶液变为橙红色,发生的反应为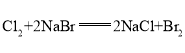
【解析】
根据元素在元素周期表中的位置,可知①~的具体元素,再结合元素周期律可知,最活泼的金属元素是![]() ,最活泼的非金属元素是
,最活泼的非金属元素是![]() ,最不活泼的元素是稀有气体元素
,最不活泼的元素是稀有气体元素![]() ,它们的最高价氧化物对应的水化物中酸性最强的是
,它们的最高价氧化物对应的水化物中酸性最强的是![]() ,碱性最强的是
,碱性最强的是![]() ,呈两性的氢氧化物是
,呈两性的氢氧化物是![]() .在比较Na与
.在比较Na与![]() 、
、![]() 与
与![]() 的活泼性差异时,可根据元素金属性、非金属性强弱比较的依据设计实验。
的活泼性差异时,可根据元素金属性、非金属性强弱比较的依据设计实验。
(1)据上分析可知,四种元素的符号分别为:①N,⑥Si,⑦S,Ca;
(2)据上分析可知:最活泼的金属元素是![]() ,最活泼的非金属元素是
,最活泼的非金属元素是![]() ,最不活泼的元素是稀有气体元素
,最不活泼的元素是稀有气体元素![]() ;
;
答案为:K; F;Ar;
(3)它们的最高价氧化物对应的水化物中酸性最强的是![]() ,碱性最强的是
,碱性最强的是![]() ,呈两性的氢氧化物是
,呈两性的氢氧化物是![]() ;氢氧化铝够与高氯酸、氢氧化钾反应,均生成盐和水,高氯酸与氢氧化钾反应生成盐和水,方程式分别为:
;氢氧化铝够与高氯酸、氢氧化钾反应,均生成盐和水,高氯酸与氢氧化钾反应生成盐和水,方程式分别为: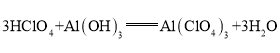 ,
,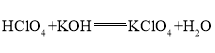 ,
,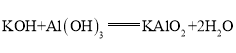 ;
;
答案为:![]() ;
; ![]() ;
;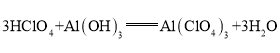 ;
;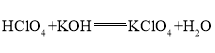 ;
;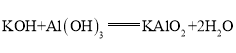 ;
;
(4)同周期从左到右原子半径递减,同主族从上到下原子半径递增,这些元素(除0族元素外)中原子半径最小的是F,原子半径最大的是K;
答案为:F;K;
(5)同周期从左到右金属性递减,化学性质Na>Mg,可通过与水反应放出氢气的剧烈程度来比较,钠与冷水剧烈反应,而镁与冷水不反应;
答案为:Na,将Na、Mg分别与水反应,![]() 跟水剧烈反应,放出氢气,镁与冷水不反应;
跟水剧烈反应,放出氢气,镁与冷水不反应;
同主族从上到下非金属性递减,单质的化学性质![]() >
>![]() ,可通过氯气能置换出溴来证明,氯气与溴化钠溶液反应,置换出溴,溶液显橙色,方程式为:
,可通过氯气能置换出溴来证明,氯气与溴化钠溶液反应,置换出溴,溶液显橙色,方程式为: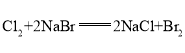 ;
;
答案为:Cl;将氯气通入溴化钠溶液中,溶液变为橙色,发生的反应为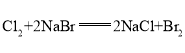 。
。

【题目】硫代硫酸钠(Na2S2O3·5H2O)俗名“大苏打”,又称为“海波”。它易溶于水,难溶于乙醇,加热、遇酸均易分解。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图:
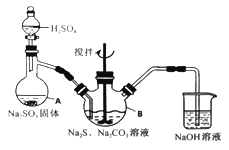
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液的滴速,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸。
②直至析出的浑浊不再消失,并控制溶液的pH接近7时,停止通入SO2气体。
……
(1)写出仪器A的名称_______。
(2)为了保证硫代硫酸钠的产量,实验中不能让溶液pH <7,请用离子方程式解释原因_________。
(3)写出三颈烧瓶B中制取Na2S2O3,反应的总化学反应方程式________。
(4)从上述生成物混合液中获得较高产率Na2S2O3·5H2O的步骤为

为减少产品的损失,操作①为趁热过滤,“趁热”的原因是______;操作②是______;操作①是抽滤、洗涤、干燥。
(5)测定产品纯度
取6.00g产品,配制成100mL溶液。取10.00mL溶液,以淀粉溶液为指示剂,用浓度为0.500mol/LI2的标准溶液进行滴定,反应原理为2S2O32-+I2=S4O62-+2I-。相关数据记录如下表所示。
编号 | 1 | 2 | 3 |
溶液的体积/mL | 10.00 | 10.00 | 10.00 |
消耗I2标准溶液的体积/mL | 19.98 | 22.50 | 20.02 |
滴定时,达到滴定终点的现象是___________。产品的纯度为____________。
(6)Na2S2O3常用作脱氧剂,在溶液中易被Cl2氧化成SO42-,该反应的离子方程式为_________。