题目内容
在100 mL NaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热充分反应,下图表示加入的混合物质量与产生的气体体积(标准状况)的关系,试计算:
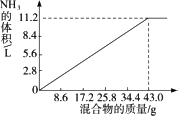
(1)NaOH溶液的物质的量浓度.
(2)当NaOH溶液的体积为140 mL,固体混合物的质量为51.6 g时,充分反应后,生成气体的体积(标准状况)为________L.
(3)当NaOH溶液的体积为180 mL,固体混合物的质量仍为51.6 g时,充分反应后,生成气体的体积(标准状况)为________L.
解析:
|
答案:(1)从图上看出34.4 g混合铵盐恰好与100 mL NaOH溶液完全反应,设NaOH溶液物质的量浓度为c. NaOH - NH3 1 mol 22.4 L b mol·L-1×0.1 L 11.2 L c= (2)15.68 L (3)16.8 L 解析:本题考查了对图示法给出信息的理解与接受能力,以及如何从中排除干扰选择必要的信息,找到解题的捷径.在阅读观察中需通过坐标、图形、数据分析反应情况.图中提供两组平行数据,其中只有一组(长虚线所对应的)是解题的依据,另一组则是多余的干扰信息.试题还将反应物之一(铵盐)设定为一种未指明相对含量的混合物(实际解题中并不需要了解其组成),这是又一次故意设置的干扰信息. (1)根据必要信息.由图中长折线所对应的纵横坐标可知:对于100 mL·NaOH溶液,随着铵盐加入量增加(加热),放出NH3的体积增大,但当铵盐加入量超过34.4 g后,NH3体积不再变化.说明100 mL溶液与34.4 g铵盐恰好完全反应.根据化学方程式: 1 mol 22.4 L c×0.1 L 11.2 L NaOH溶液浓度c= (2)计算140 mL NaOH溶液与51.6 g铵盐反应时放出的氨气的体积时,应先计算过量:以铵盐为准,设需NaOH的体积为x,则 (3)由第(2)小题得知51.6 g铵盐固体混合物完全反应需150 mL NaOH溶液,现有180 mL NaOH溶液,显然此时铵盐不足量,计算时应以铵盐为准,设生成NH3的体积为z.
|

|
用NA表示阿伏加德罗常数的数值,下列说法正确的是 | |
| [ ] | |
A. |
常温下,1 mol D2O含质子数为12 NA |
B. |
在100 mL 0.5 mol/L盐酸中含有HCl分子0.05NA |
C. |
标准状况下,1L水中所含分子数为 |
D. |
15.6 g Na2O2与过量CO2反应时,转移的电子数为0.2 NA |

