题目内容
向含SO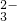 、Fe2+、Br-、I-各0.1mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量的关系图正确的是
、Fe2+、Br-、I-各0.1mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量的关系图正确的是
- A.

- B.

- C.

- D.

C
分析:离子还原性SO32->I->Fe2+>Br-,故首先发生反应SO32-+Cl2+H2O=SO42-+2Cl-+2H+,再发生反应2I-+Cl2=2I2+2Cl-,然后发生反应2Fe2++Cl2=2Fe3++2Cl-,最后发生反应2Br-+Cl2=2Br2+2Cl-,根据发生反应顺序计算离子开始反应到该离子反应完毕时氯气的体积,据此判断.
解答:离子还原性SO32->I->Fe2+>Br-,故首先发生反应SO32-+Cl2+H2O=SO42-+2Cl-+2H+,再发生反应2I-+Cl2=I2+2Cl-,然后发生反应2Fe2++Cl2=2Fe3++2Cl-,最后发生反应2Br-+Cl2=Br2+2Cl-,根据发生反应顺序计算离子开始反应到该离子反应完毕时氯气的体积,
A.由SO32-+Cl2+H2O=SO42-+2Cl-+2H+可知,0.1molSO32-完全反应需要消耗0.1mol氯气,标准状况下的Cl2的体积为0.1mol×22.4L/mol=2.24L,图象中氯气的体积不符合,故A错误;
B.0.1molSO32-完全反应后,才发生2I-+Cl2=I2+2Cl-,0.1molSO32-完全反应需要消耗0.1mol氯气,故开始反应时氯气的体积为2.24L,0.1molI-完全反应消耗0.05氯气,故0.1molI-完全反应时氯气的体积为0.15mol×22.4L/mol=3.36L,图象中氯气的体积不符合,故B错误;
C.0.1molSO32-完全反应需要消耗0.1mol氯气,0.1molI-完全反应消耗0.05氯气,故亚铁离子开始反应时氯气的体积为0.15mol×22.4L/mol=3.36L,由2Fe2++Cl2=2Fe3++2Cl-可知,0.1molFe2+完全反应消耗0.05氯气,故Fe2+完全时消耗的氯气体积为0.2mol×22.4L/mol=4.48L,图象与实际符合,故C正确;
D.SO32-、I-、Fe2+完全时消耗的氯气体积为0.2mol×22.4L/mol=4.48L,即溴离子开始反应时氯气的体积为4.48L,由2Br-+Cl2=2Br2+2Cl-可知,0.1molBr-完全反应消耗0.05氯气,故溴离子完全反应时消耗氯气的体积为4.48L+0.05mol×22.4L/mol=5.6L,图象中氯气的体积不符合,故D错误;
故选C.
点评:本题以图象形式考查氧化还原反应、有关离子反应计算等,难度中等,确定离子反应发生的先后顺序是解题的关键.
分析:离子还原性SO32->I->Fe2+>Br-,故首先发生反应SO32-+Cl2+H2O=SO42-+2Cl-+2H+,再发生反应2I-+Cl2=2I2+2Cl-,然后发生反应2Fe2++Cl2=2Fe3++2Cl-,最后发生反应2Br-+Cl2=2Br2+2Cl-,根据发生反应顺序计算离子开始反应到该离子反应完毕时氯气的体积,据此判断.
解答:离子还原性SO32->I->Fe2+>Br-,故首先发生反应SO32-+Cl2+H2O=SO42-+2Cl-+2H+,再发生反应2I-+Cl2=I2+2Cl-,然后发生反应2Fe2++Cl2=2Fe3++2Cl-,最后发生反应2Br-+Cl2=Br2+2Cl-,根据发生反应顺序计算离子开始反应到该离子反应完毕时氯气的体积,
A.由SO32-+Cl2+H2O=SO42-+2Cl-+2H+可知,0.1molSO32-完全反应需要消耗0.1mol氯气,标准状况下的Cl2的体积为0.1mol×22.4L/mol=2.24L,图象中氯气的体积不符合,故A错误;
B.0.1molSO32-完全反应后,才发生2I-+Cl2=I2+2Cl-,0.1molSO32-完全反应需要消耗0.1mol氯气,故开始反应时氯气的体积为2.24L,0.1molI-完全反应消耗0.05氯气,故0.1molI-完全反应时氯气的体积为0.15mol×22.4L/mol=3.36L,图象中氯气的体积不符合,故B错误;
C.0.1molSO32-完全反应需要消耗0.1mol氯气,0.1molI-完全反应消耗0.05氯气,故亚铁离子开始反应时氯气的体积为0.15mol×22.4L/mol=3.36L,由2Fe2++Cl2=2Fe3++2Cl-可知,0.1molFe2+完全反应消耗0.05氯气,故Fe2+完全时消耗的氯气体积为0.2mol×22.4L/mol=4.48L,图象与实际符合,故C正确;
D.SO32-、I-、Fe2+完全时消耗的氯气体积为0.2mol×22.4L/mol=4.48L,即溴离子开始反应时氯气的体积为4.48L,由2Br-+Cl2=2Br2+2Cl-可知,0.1molBr-完全反应消耗0.05氯气,故溴离子完全反应时消耗氯气的体积为4.48L+0.05mol×22.4L/mol=5.6L,图象中氯气的体积不符合,故D错误;
故选C.
点评:本题以图象形式考查氧化还原反应、有关离子反应计算等,难度中等,确定离子反应发生的先后顺序是解题的关键.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
根据下列实验内容得出的结论正确的是( )
|
(2011?湛江模拟)一定温度下的难溶电解质AmBn在水溶液中达到溶解平衡时.已知下表数据
|
某溶液除水电离出的HO-、H+之外仅含Fe2+、Na+、Al3+、Ba2+、SO
、NO
、Cl-中的4种,这4种离子的物质的量均为0.1mol.若向该溶液中加入少量稀硫酸,无沉淀生成但有气泡产生.下列说法错误的是( )
2- 4 |
- 3 |
| A、该溶液中肯定不含Ba2+ | ||||
| B、若向该溶液中加入过量的稀硫酸,溶液中的阴离子会减少一种 | ||||
| C、若向该溶液中加入足量NaOH溶液,滤出沉淀,洗净灼烧后最多能得8.0g固体 | ||||
D、该溶液中除H+、0H-之外所含离子是Fe2+、Na+、NO
|