题目内容
18.表为元素周期表中短周期的一部分,下列说法正确的是( )| ① | ② | ③ |
| ④ | ⑤ | ⑥ |
| A. | ①~⑥不可能出现金属元素 | |
| B. | 气态氢化物的稳定性:②>③ | |
| C. | 原子半径:①>②>③>④ | |
| D. | ④的最高价氧化物对应的水化物可能为两性物质 |
分析 由图可知,①、②、③位于第二周期,后三种元素位于第三周期,
A.④可能为Al元素;
B.非金属性越强,对应氢化物越稳定;
C.电子层越多,原子半径越大,同周期从左向右原子半径减小;
D.④可为Al,氢氧化铝与强酸、强碱均反应生成盐和水.
解答 解:A.④可能是Al,为金属元素,故A错误;
B.同周期元素从左到右金属性逐渐减弱,非金属性逐渐增强,气态氢化物的稳定性也逐渐增强,因此气态氢化物的稳定性②<③,故B错误;
C.同周期元素从左到右原子半径逐渐减小,则原子半径①>②>③,同主族元素从上到下,原子半径逐渐增大,则原子半径④>①,因此原子半径④>①>②>③,故C错误;
D.④可能是Al,④的最高价氧化物对应的水化物为Al(OH)3,为两性物质,故D正确;
故选D.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
13.化学与生产、生活密切相关,下列说法正确的是( )
| A. | 煤的干馏可得煤油、石蜡和沥青 | |
| B. | 工业上以氯气和石灰乳为原料制备漂白粉 | |
| C. | 干燥剂硅胶和硅橡胶的主要成分都是二氧化硅 | |
| D. | 二氧化硫有漂白性,常用作棉、麻和食品的漂白 |
6.在密闭容器中发生下列反应:aA(g)═cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,A的浓度为原平衡的2.1倍,则 a<c+d(填“>”、“=”或“<”).
13.对下列实验现象的解释正确的是( )
| 现象 | 解释 | |
| A | KI淀粉溶液通入Cl2,溶液变蓝 | Cl2能与淀粉发生显色反应 |
| B | 向溴水中通入SO2,溶液变无色 | SO2表现还原性 |
| C | 向某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 说明该溶液中含有SO42- |
| D | 铜片放入浓硫酸中,无明显变化 | 说明铜在冷的浓硫酸中发生钝化 |
| A. | A | B. | B | C. | C | D. | D |
3.下列实验仪器不能用来加热的是( )
| A. | 试管 | B. | 坩埚 | C. | 分液漏斗 | D. | 烧杯 |
8.化学在生活中应用广泛,下列物质性质与对应用途错误的是( )
| A. | 明矾易水解生成胶体,可用作净水剂 | |
| B. | 晶体硅熔点高硬度大,可用作芯片 | |
| C. | 氮气化学性质稳定,可用作粮食保护气 | |
| D. | 溴化银见光易分解,可用作胶片感光剂 |
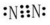 .
.