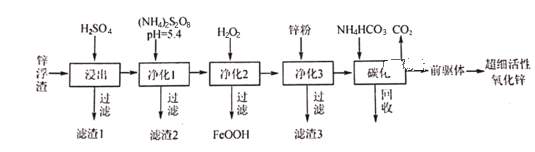
��Ŀ����
����Ŀ������һ����Ҫ�Ľ�������������[��Ҫ�ɷ�Ϊ����������FeTiO3��������������Fe2O3]Ϊԭ���Ʊ��ѵĹ���������ͼ��ʾ��
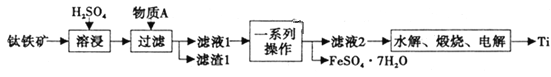
��1����Һ1����Ԫ����TiO2+��ʽ���ڣ����ܽ������̷�������Ҫ��Ӧ�Ļ�ѧ����ʽΪ________��
��2������AΪ________���ѧʽ������һϵ�в�����Ϊ________��
��3����ˮ�⡱����������TiO2��xH2O��Ϊ���TiO2��xH2O�IJ��ʣ��ɲ�ȡ�Ĵ�ʩ��________��________����д����������
��4������⡱����ʯīΪ������TiO2Ϊ����������CaOΪ����ʡ������ĵ缫��ӦʽΪ________�����Ƶý���Ti 9.60g��������������________mL����״���£���
��5��������FeSO4��7H2O����ˮ������һ������NaHCO3��Һ�����Ƶ�FeCO3��д����Ӧ�����ӷ���ʽ________������Ӧ�����Һ��c��Fe2+��=2��10-6mol��L-1������Һ��c��CO32-��=________mol��L-1������֪��������FeCO3������ҺŨ��Ϊ4.5��10-6mol��L-1��
���𰸡�FeTiO3��2H2SO4 ![]() TiOSO4��FeSO4��2H2O Fe ����Ũ������ȴ�ᾧ������ ��ˮϡ�ͷ�Ӧ�� �Ӽ��к����ɵ��ᡢ���ȵ� TiO2��4e��===Ti��2O2�� 4480��2�֣� Fe2+ + 2HCO3����FeCO3��+CO2��+ H2O 1��10��5
TiOSO4��FeSO4��2H2O Fe ����Ũ������ȴ�ᾧ������ ��ˮϡ�ͷ�Ӧ�� �Ӽ��к����ɵ��ᡢ���ȵ� TiO2��4e��===Ti��2O2�� 4480��2�֣� Fe2+ + 2HCO3����FeCO3��+CO2��+ H2O 1��10��5
��������
����������ᷴӦ���������Ѻ����������������������ᷴӦ������������ˮ��������������̷��������м��������ӱ���������ӵĹ��̣����Լ�������AΪ��������������Һͨ������Ũ������ȴ�ᾧ�����˵õ������������塣���ݵ���������ʧȥ���ӷ���������Ӧ�������õ����ӷ�����ԭ��Ӧ�����缫��Ӧ����ʽ��
��1������������Ҫ�ɷ�ΪFeTiO3������Һ1����Ԫ����TiO2+��ʽ���ڣ���������Ҫ��Ӧ��ѧ����ʽΪFeTiO3��2H2SO4 ![]() TiOSO4��FeSO4��2H2O��
TiOSO4��FeSO4��2H2O��
��2���������л��и�����FeSO4��7H2O�����轫�ܽ������е�Fe3+��ȥ������AΪFe����һϵ�в�������������Ũ������ȴ�ᾧ�����ˡ�
��3�� ��ˮ�⡱��ӦΪTiO2����(x��1)H2O===TiO2��xH2O����2H��������ƽ���ƶ�ԭ����Ϊ���TiO2��xH2O�IJ��ʿ��Լ�ˮϡ�ͷ�Ӧ��Ӽ��к����ɵ��ᡢ���ȵȡ�
��4������⡱������������Ӧ��TiO2��4e��===Ti��2O2����������Ӧ��2O2����4e��===O2�������Ƶý���Ti 9.60g����n(Ti)=n(O2)=0.2mol��V(O2)=4480mL����״���£���
��5��������֪�÷�Ӧ��ѧ����ʽΪ��Fe2+ + 2HCO3����FeCO3��+CO2��+ H2O���ɳ�����FeCO3������ҺŨ��Ϊ4.5��10��6 mol��L-1��KSP(FeCO3)=2.025��10��11 mol2��L-2����c(CO32��)��![]() = 1.013��10��5mol��L-1��
= 1.013��10��5mol��L-1��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ�����и�����������Һ�п��Դ������棬�Ҽ����ͨ���Լ�X������Ӧ�����ӷ���ʽҲ��ȷ����( )
ѡ�� | ���� | �����Լ� | ������Ӧ�����ӷ���ʽ |
A | I-��Cl-��H+��SO42- | NaNO3 | 6I-+2NO3-+8H+=2NO��+4H2O+3I2 |
B | CO32-��Fe3+��Br-��SO42- | KSCN | 3SCN-+Fe3+ |
C | HClO��Na+��K+��SO32- | CaCl2 | Ca2++ SO32-=CaSO3�� |
D | K+��Na+��HCO3-��AlO2- | HCl | H++AlO2-+H2O=Al(OH)3�� |
A.AB.BC.CD.D
����Ŀ������ʵ���о��к���ɫ����������Աȷ������ý��۲���ȷ���ǣ� ��
|
|
|
�� | �� | �� |
A.�ɢ��еĺ���ɫ���壬�ƶϲ���������һ���ǻ������
B.����ɫ���岻�ܱ�������ľ̿��Ũ���ᷢ���˷�Ӧ
C.�ɢ�˵��Ũ������лӷ��ԣ����ɵĺ���ɫ����Ϊ��ԭ����
D.�۵���������м���CO2���ɴ�˵��ľ̿һ����Ũ���ᷢ���˷�Ӧ
����Ŀ��ij�¶��£���ӦH2(g)+CO2(g)![]() H2O(g)+CO(g)��ƽ�ⳣ��K=
H2O(g)+CO(g)��ƽ�ⳣ��K=![]() �����¶��£��ڼס��ҡ������������ܱ������У�Ͷ��H2(g)��CO2(g)������ʼŨ�������ʾ��
�����¶��£��ڼס��ҡ������������ܱ������У�Ͷ��H2(g)��CO2(g)������ʼŨ�������ʾ��
�� | �� | �� | |
c(H2)/(mol��L-1) | 0.010 | 0.020 | 0.020 |
c(CO2)/(mol��L-1) | 0.010 | 0.010 | 0.020 |
�����жϲ���ȷ����( )
A. ��Ӧ��ʼʱ���������л�ѧ��Ӧ������������л�ѧ��Ӧ������С
B. ƽ��ʱ����������CO2��ת���ʴ���60%
C. ƽ��ʱ���������кͱ�������H2��ת���ʾ���60%
D. ƽ��ʱ����������c(CO2)�Ǽ������е�2������ 0.012 mol��L-1