题目内容
16.设NA表示阿伏加德罗常数,下列叙述中正确的是( )| A. | 常温常压下,11.2LNH3所含的原子数为2NA | |
| B. | 常温常压下,80gSO3含有的氧原子数为3NA | |
| C. | 标准状况下,22.4LH2中所含原子数为NA | |
| D. | 2 L0.3 mol•L-1 Na2SO4溶液中含0.6NA个Na+ |
分析 A、常温常压下,气体摩尔体积大于22.4L/mol;
B、求出三氧化硫的物质的量,然后根据1mol三氧化硫中含3mol氧原子来分析;
C、求出氢气的物质的量,然后根据1mol氢气中含2mol氢原子来分析;
D、求出硫酸钠的物质的量,然后根据1mol硫酸钠中含2mol钠离子来分析.
解答 解:A、常温常压下,气体摩尔体积大于22.4L/mol,故11.2L氨气的物质的量小于0.5mol,故含有的原子数小于2NA个,故A错误;
B、80g三氧化硫的物质的量为1mol,而1mol三氧化硫中含3mol氧原子,即3NA个,故B正确;
C、标况下22.4L氢气的物质的量为1mol,而1mol氢气中含2mol氢原子即2NA个,故C错误;
D、溶液中硫酸钠的物质的量n=CV=0.3mol/L×2L=0.6mol,而1mol硫酸钠中含2mol钠离子,故0.6mol硫酸钠中含1.2mol钠离子即1.2NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
6.质量相等的硫酸和磷酸,它们的( )相等.
| A. | 物质的量 | B. | 原子个数 | C. | 氢原子个数 | D. | 分子中的电子数 |
4.Na2O、NaOH、Na2CO3、NaCl、Na2SO4可按某种标准划为同一类物质,下列分类标准正确的是( )
①钠的化合物 ②钠盐 ③可溶于水的物质 ④电解质⑤水溶液能导电的化合物
⑥氧化物 ⑦是由离子形成的化合物.
①钠的化合物 ②钠盐 ③可溶于水的物质 ④电解质⑤水溶液能导电的化合物
⑥氧化物 ⑦是由离子形成的化合物.
| A. | ②③④⑦ | B. | ②⑤⑥⑦ | C. | ①③④⑤⑦ | D. | ①②⑤⑥ |
11.T℃时,在2L的密闭容器中,A气体与B气体发生可逆反应生成C气体,反应过程中A、B、C物质的量变化如图(Ⅰ)所示.若保持其他条件不变,温度分别为T1和T2时,B的物质的量分数与时间关系如图(Ⅱ)所示.下列叙述正确的是( )


| A. | 2min内A的化学反应速率为0.1 mol/(L•min) | |
| B. | 在反应达平衡时,保持其他条件不变,增大压强,正逆反应速率都增大,且平衡向逆反应方向移动 | |
| C. | 在反应达平衡时,其他条件不变,升高温度,正逆反应速率都增大,且A的转化率增大 | |
| D. | T1和T2时的平衡常数大小关系:前者小于后者 |
8.少量铁粉与100mL 0.01mol/L的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸④加NaCl溶液
⑤改用10mL 0.1mol/L的盐酸⑥滴加几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发)
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸④加NaCl溶液
⑤改用10mL 0.1mol/L的盐酸⑥滴加几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发)
| A. | ①⑥⑦ | B. | ③⑤⑦ | C. | ①④⑦ | D. | ③⑥⑦ |
6.下列离子在溶液中能大量共存的是( )
| A. | Fe3+、Al3+、SCN-、Cl- | B. | Na+、Ca2+、HCO3-、Cl- | ||
| C. | Fe3+、Na+、S2-、Cl- | D. | K+、H+、Cl-、AlO2- |
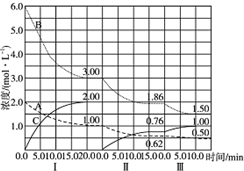 反应:aA(g)+bB(g)$\stackrel{催化剂}{?}$cC(g)(△H<0)在等容条件下进行.改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图示:
反应:aA(g)+bB(g)$\stackrel{催化剂}{?}$cC(g)(△H<0)在等容条件下进行.改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图示:


