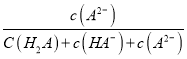题目内容
【题目】已知K2HPO4溶液呈碱性,即HPO42-结合H+的能力大于其电离产生H+的能力。下列操作能使该溶液中c(H3O+)增大的是( )
A.加水B.加热C.加消石灰D.加K2HPO4
【答案】A
【解析】
K2HPO4溶液呈碱性,即HPO42-的水解大于电离;HPO42-的电离:![]() ,HPO42-的一步水解:
,HPO42-的一步水解:![]() ;c(H3O+)即为氢离子浓度。
;c(H3O+)即为氢离子浓度。
A.加水,整体分析,溶液碱性减弱,则溶液中氢离子浓度增大,故A正确;
B.升高温度,溶液中的电离、水解均为吸热反应,平衡正向移动,依旧水解大于电离,且碱性增强,故B错误;
C.加消石灰,消石灰的主要成分为氢氧化钙,则增大了![]() 增大,故C错误;
增大,故C错误;
D.同离子效应,增大反应物浓度,平衡正向进行,依旧水解大于电离,碱性增强,故D错误;
答案选A。

练习册系列答案
 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目