题目内容
某10%的NaOH溶液,加热蒸发掉100克水后得到80mL20%的溶液,在此过程中,无NaOH析出,则该20%的NaOH溶液的物质的量浓度为
- A.6.25mol/L
- B.7 mol/L
- C.7.5 mol/L
- D.12.5 mol/L
分析:蒸发前后,溶质的质量不变,设原溶液的质量为x,x×10%=(x-100g)×20%,解得x=200g,m(NaOH)=200g×10%=20g,结合n=
 、c=
、c= 计算解答.
计算解答.解答:蒸发前后,溶质的质量不变,设原溶液的质量为x,x×10%=(x-100g)×20%,解得x=200g,
m(NaOH)=200g×10%=20g,则n(NaOH)=
 =
= =0.5mol,
=0.5mol,该20%的NaOH溶液的物质的量浓度为c=
 =
= =6.25mol/L,
=6.25mol/L,故选A.
点评:本题考查物质的量浓度的计算,明确蒸发前后溶质的质量不变及基本计算公式即可解答,题目难度不大.

| A、某温度下任何电解质的水溶液中,pC(H+)+pC(OH-)=14 | B、0.01mol/L的CaCl2溶液中逐渐滴加纯碱溶液,滴加过程中pC(Ca2+)逐渐减小 | C、用0.01mol/L的盐酸滴定某浓度的NaOH溶液,滴定过程中pC(H+)逐渐增大 | D、某温度下,AB难溶性离子化合物的Ksp=1.0×10-10,其饱和溶液中pC(A+)+pC(B-)=10 |
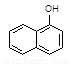
1-乙氧基萘是一种无色液体,密度比水大,不溶于水,易溶于乙醇,熔点5.5℃,沸点267℃。1-萘酚(性质与苯酚相似)熔点96℃,沸点278℃,微溶于水,易溶于乙醇,乙醇的沸点为78.5℃。1-乙氧基萘常用作香料,也可合成其他香料。实验室制备1-乙氧基萘的过程如下:
 +C2H5OH
+C2H5OH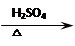
 +H2O
+H2O
1-萘酚 1-乙氧基萘
(1)将72g1-萘酚溶于100mL无水乙醇中,加入5mL浓硫酸混合。将混合液置于如图所示的容器中加热充分反应。实验中使用过量乙醇的原因是 。烧瓶上连接长直玻璃管的主要作用是 。
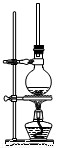
(2)反应结束,将烧瓶中的液体倒入冷水中,经处理得到有机层。为提纯产物有以下四步操作:①蒸馏;②水洗并分液;③用10%的NaOH溶液碱洗并分液;④用无水氯化钙干燥并过滤。正确的顺序是 (填序号)。
A.③②④① B.①②③④ C.②①③④
(3)实验测得1-乙氧基萘的产量与反应时间、温度的变化如图所示,时间延长、温度升高,1-乙氧基萘的产量下降的原因可能是 、 。
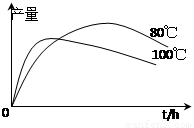
(4)某同学推测经提纯的产品可能还含有1-萘酚、乙醇、硫酸和水等杂质,设计了如下方案进行检验,请在答题卡上完成表中内容。
|
实验目的 |
实验操作 |
预期现象和结论 |
|
①用金属钠检验1-乙氧基萘是否纯净 |
取少量经提纯的产品于试管A中,加入金属钠 |
若 ,则产品纯净; 若 ,则产品不纯。 |
|
②检验经提纯的产品是否含有1-萘酚 |
|
若 ,则含有1-萘酚; 若 ,则不含1-萘酚。 |
 (1)写出下列物质溶于水的电离方程式①冰醋酸溶于水:
(1)写出下列物质溶于水的电离方程式①冰醋酸溶于水: CH3COOH+Cu2O↓+2H2O”提出了质疑,并进行如下探究:
CH3COOH+Cu2O↓+2H2O”提出了质疑,并进行如下探究: