题目内容
4. 室温下,将1.000mol•L-1盐酸滴入20.00mL 1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.
室温下,将1.000mol•L-1盐酸滴入20.00mL 1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.(1)a点由水电离出的c (H+)=1.0×10-12mol•L-1.
(2)d点溶液温度最高的原因是d点时盐酸和氨水恰好完全反应,放热最多.
分析 (1)根据pH计算氢离子浓度,对于碱溶液,水电离出的氢离子浓度和溶液中氢离子浓度相等;
(2)当酸碱溶液恰好完全反应时放热热量最大,据此进行判断.
解答 解:(1)因a点pH=12,则c(H+)=1.0×10-12mol•L-1,氨水为弱碱溶液,氢氧根离子抑制了水的电离,则溶液中氢离子为水电离出的氢离子,
故答案为:1.0×10-12mol•L-1;
(2)根据图象可知,d点放热热量最高,说明此时盐酸和氨水恰好完全反应,
故答案为:d点时盐酸和氨水恰好完全反应,放热最多.
点评 本题考查水溶液中的电离平衡以及酸碱中和滴定,题目难度不大,明确滴定曲线中各点含义为解答的关键,注意掌握酸碱混合的定性判断加入溶液pH的关系,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
9.已知某有机物X的结构简式如图所示,下列有关叙述不正确的是( )
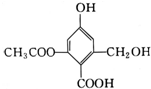

| A. | X的化学式为C10H10O6 | |
| B. | X在一定条件下能与FeCl3溶液发生显色反应 | |
| C. | X在一定条件下能发生消去反应和酯化反应 | |
| D. | 1 mol X分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗的物质的量分别为3 mol、4 mol、1 mol |
10.某学习小组用铁与稀硫酸反应探究“影响化学反应速率因素”,数据如表:
请分析上表信息,下列说法错误的是( )
| 实验 序号 | 铁的质量/g | 铁的 形态 | V(H2SO4) /mL | c(H2SO4) /mol•L-1 | 反应前溶液 的温度/℃ | 金属完全消 失的时间/s |
| ① | 0.10 | 片状 | 50 | 0.8 | 20 | 200 |
| ② | 0.10 | 粉状 | 50 | 0.8 | 20 | 25 |
| ③ | 0.10 | 片状 | 50 | 1.0 | 20 | 125 |
| ④ | 0.10 | 片状 | 50 | 1.0 | 35 | 50 |
| A. | 实验①和②表明固体反应物的表面积越大,反应速率越大 | |
| B. | 仅表明反应物浓度对反应速率产生影响的实验有①和③ | |
| C. | 实验③和④表明反应物温度越高,反应速率越小 | |
| D. | 实验③将稀硫酸改为同体积、c(H+)相同的盐酸(其他条件不变),发现放出气泡的速率盐酸明显比硫酸快,其可能的原因是Cl-起催化作用 |
12.下列烷烃分子中去掉一个氢原子后所得的烃基只有一种的是( )
| A. | 甲烷 | B. | 戊烷 | C. | 丙烷 | D. | 丁烷 |
19.为提纯如表物质(括号内的物质为杂质),所选用的除杂试剂和分离方法都正确的是( )
| A | B | C | D | |
| 被提纯物质 | 酒精(水) | 乙醇(乙酸) | 乙烷(乙烯) | 溴苯(溴) |
| 除杂试剂 | 生石灰 | 氢氧化钠溶液 | 酸性高锰 酸钾溶液 | KI溶液 |
| 分离方法 | 蒸馏 | 分液 | 洗气 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
9.有关下列反应的离子方程式书写正确的是( )
| A. | 稀盐酸与澄清石灰水反应:H++OH-═H2O | |
| B. | CaCO3与稀盐酸反应:CO32-+2H+═CO2↑+H2O | |
| C. | AlCl3溶液与氨水反应:Al3++3OH-═Al(OH)3↓ | |
| D. | CuSO4溶液与Ba(OH)2溶液反应:SO42-+Ba2+═BaSO4↓ |
13.下列物质中,其主要成分不属于烃的是( )
| A. | 汽油 | B. | 生物柴油 | C. | 煤油 | D. | 润滑油 |
14.如表实验操作能够达到实验目的是( )
| 实验操作 | 实验目的 | |
| A | 取绿豆大小、等体积的钠块分别投入等体积的水和乙醇中 | 证明乙醇烃基中的氢原子不如水分子中的氢原子活泼 |
| B | 将形状、大小均相等的铁片分别投入等体积的稀硫酸和浓硫酸中 | 证明溶液浓度越大,反应速度越快 |
| C | 将石蜡在催化作用下加强热,产生的气体通入溴的四氯化碳溶液中 | 证明石蜡分解产物是乙烯 |
| D | 向蔗糖溶液中加入稀硫酸,水浴加热一段时间,再加入新制的氢氧化铜悬浊液,用酒精灯加热 | 证明蔗糖水解可以生成葡萄糖 |
| A. | A | B. | B | C. | C | D. | D |
 检验如图装置的气密性,通常是将导管放入水中,①用手握住烧瓶,观察判导管口有气泡冒出,②手离开烧瓶后,导管中有一段水柱上升,说明装置不漏气.请回答:
检验如图装置的气密性,通常是将导管放入水中,①用手握住烧瓶,观察判导管口有气泡冒出,②手离开烧瓶后,导管中有一段水柱上升,说明装置不漏气.请回答: