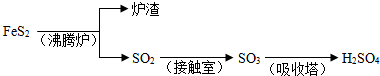
题目内容
已知

图Ⅰ 图Ⅱ
则下列结论正确的是( )
A.在t0时,其他条件不变,增大压强,平衡向逆反应方向移动
B.其他条件不变,升高温度,v(正)减小,v(逆)增大,平衡向逆反应方向移动
C.正反应为吸热反应
D.该反应的化学方程式为X+3Y![]() 2Z
2Z
D
解析:本题考查学生的识图能力和知识综合分析能力。转化的浓度之比等于化学方程式中的计量数之比。由图可知该反应为可逆反应,Y消耗0.6 mol·L-1,X消耗0.2 mol·L-1,Z增加0.4 mol·L-1,所以反应的化学方程式为X+3Y![]() 2Z;增大压强,平衡向正反应方向移动;升高温度,反应速率无论正、逆都增大。由图Ⅱ可知,温度升高。Y%含量升高,说明平衡向逆反应方向移动,所以逆反应为吸热反应,正反应为放热反应。
2Z;增大压强,平衡向正反应方向移动;升高温度,反应速率无论正、逆都增大。由图Ⅱ可知,温度升高。Y%含量升高,说明平衡向逆反应方向移动,所以逆反应为吸热反应,正反应为放热反应。

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目