题目内容
高锰酸钾是一种典型的强氧化剂.在用KMnO4酸性溶液处理Cu2S固体时,发生如下反应: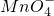 +Cu2S+H+=Cu2++SO2+Mn2++H2O(未配平).下列说法正确的是
+Cu2S+H+=Cu2++SO2+Mn2++H2O(未配平).下列说法正确的是
- A.被氧化的元素只有S
- B.
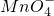 是氧化剂,既Cu2S是氧化剂又是还原剂
是氧化剂,既Cu2S是氧化剂又是还原剂 - C.氧化性的强弱关系是:
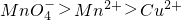
- D.生成2.24L片(标况下)SO2时反应中转移电子的物质的量是0.8mol
D
分析:A、分析反应中元素化合价变化,化合价升高的元素被氧化;
B、依据元素化合价变化判断,元素化合价升高的物质做还原剂,元素化合价降低的物质做氧化剂;
C、氧化还原反应中氧化剂的氧化性大于氧化产物;
D、依据电子守恒计算.
解答:A、反应中铜元素化合价从+1价升高到+2价,硫元素化合价从-2价升高到+4价,化合价升高的元素被氧化,所以被氧化的元素有S、Cu,故A错误;
B、依据化合价变化,锰元素化合价降低,高猛酸钾做氧化剂,Cu2S元素化合价都升高做还原剂,故B错误;
C、氧化还原反应中氧化剂的氧化性大于氧化产物;所以氧化剂MnO4-的氧化性大于氧化产物Cu2+;Mn2+的氧化性小于铜离子,故C错误;
D、生成2.24LL(标况下)SO2时,物质的量为0.1mol;反应的Cu2S物质的量为0.1mol,反应中转移电子的物质的量是:
Cu+~Cu2+~e-; S2-~SO2~6e-;0.8mol
1 1 1 6
0.2mol 0.2mol 0.1mol 0.6mol
所以电子转移共0.8mol;
故D正确;
故选D.
点评:本题考查了氧化还原反应的概念分析判断,电子转移计算应用,关键是化合价变化的分析和规律的应用,题目难度中等.
分析:A、分析反应中元素化合价变化,化合价升高的元素被氧化;
B、依据元素化合价变化判断,元素化合价升高的物质做还原剂,元素化合价降低的物质做氧化剂;
C、氧化还原反应中氧化剂的氧化性大于氧化产物;
D、依据电子守恒计算.
解答:A、反应中铜元素化合价从+1价升高到+2价,硫元素化合价从-2价升高到+4价,化合价升高的元素被氧化,所以被氧化的元素有S、Cu,故A错误;
B、依据化合价变化,锰元素化合价降低,高猛酸钾做氧化剂,Cu2S元素化合价都升高做还原剂,故B错误;
C、氧化还原反应中氧化剂的氧化性大于氧化产物;所以氧化剂MnO4-的氧化性大于氧化产物Cu2+;Mn2+的氧化性小于铜离子,故C错误;
D、生成2.24LL(标况下)SO2时,物质的量为0.1mol;反应的Cu2S物质的量为0.1mol,反应中转移电子的物质的量是:
Cu+~Cu2+~e-; S2-~SO2~6e-;0.8mol
1 1 1 6
0.2mol 0.2mol 0.1mol 0.6mol
所以电子转移共0.8mol;
故D正确;
故选D.
点评:本题考查了氧化还原反应的概念分析判断,电子转移计算应用,关键是化合价变化的分析和规律的应用,题目难度中等.

练习册系列答案
相关题目
高锰酸钾是一种典型的强氧化剂,无论在实验室还是在化工生产中都有重要的应用.如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).

(1)制备氯气选用的药品为:高锰酸钾和浓盐酸,相应的离子方程式为: .
(2)装置B的作用是 ,监测实验进行时C中可能发生堵塞,请写出发生堵塞时B中的现象 .
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ依次放入 .(选a或b或c)
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性.当向D中缓缓通入足量氯气时,可以看到无色溶液逐渐变为红棕色,说明氯的非金属性大于溴.打开活塞,将D中的少量溶液加入E中,振荡E.观察到的现象是 .该现象 (填“能”或“不能”)说明溴的非金属性强于碘,原因是 .

(1)制备氯气选用的药品为:高锰酸钾和浓盐酸,相应的离子方程式为:
(2)装置B的作用是
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ依次放入
| a | b | c | |
| I | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |

