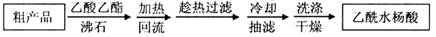题目内容
某学习小组在实验室以食盐为原料模拟氯碱工业.步骤有①粗盐的提纯、②电解饱和食盐水.具体流程如下:
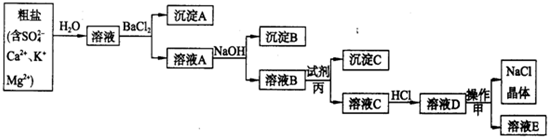
第一步:粗盐(含 )的提纯.
)的提纯.

请回答:
(1)试剂丙的化学式为______,目的是除去溶液B中的______ (写离子符号).
(2)用离子方程式表示溶液C中加入HCl后发生的化学反应:______.
(3)溶液E中含有的离子是______(写离子符号).
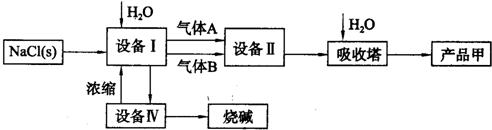
第二步:用提纯后的食盐晶体制备化工产品烧碱和产品甲.

请回答:
(4)设备II内火焰的颜色是______.其化学反应为______.
(5)设备Ⅰ中电解一段时间后,测得溶液的pH值为13.若以电解100mL.溶液计算(忽略溶液体积的变化),此时阴极产生气体的体积是______mL.若恢复原溶液的成分和浓度,需要加入______(物质名称)______g.
(6)若粗盐不经过第一步的提纯,直接进入第二步中的设备I,设备I中溶液出现的现象是______.电解时发生反应的离子方程式为______、______.
解:(1)欲除去溶液I中的Mg2+、Ca2+、SO42-,则用氢氧化镁除掉Mg2+,用氯化钡除掉SO42-,用碳酸钠除掉Ca2+与多余的Ba2+,根据流程图可知试剂丙为碳酸钠;其作用为除掉掉Ca2+与多余的Ba2+,故答案为:Na2CO3;Ca2+、Ba2+;
(2)溶液C中的成分为碳酸钠、氢氧化钠、氯化钠、氯化钾,能与盐酸反应的有碳酸钠、氢氧化钠,离子方程式为:CO32-+2H+═H2O+CO2↑,H++OH-=H2O,
故答案为:CO32-+2H+═H2O+CO2↑,H++OH-=H2O;
(3)根据溶液D中的成分为:氯化钠、氯化钾和过量的盐酸,操作甲为降温结晶,溶液E中含有氯化钠、氯化钾和过量的盐酸,含有的离子有:Na+、K+、H+、OH-、Cl-,
故答案为:Na+、K+、H+、OH-、Cl-.
(4)根据电解饱和食盐水得到氢氧化钠、氢气、氯气,氢气在氯气中燃烧火焰呈苍白色,故答案为:苍白色;H2+Cl2 2HCl;
2HCl;
(5)溶液的pH值为13,c(OH-)=0.1mol/L,n(NaOH)=cV=0.1mol/L×0.1L=0.01mol
2NaCl+2H2O 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
2 1 1
0.01mol n(Cl2) n(H2)
n(Cl2)=0.005mol n(H2)=0.005mol
阴极产生的氢气的体积n(氢气)=0.005mol×22.4L/mol=0.112L=112mL,
m(Cl2)+m(H2)=0.005mol×71g/mol+0.005mol×2g/mol=0.365g,
所以若恢复原溶液的成分和浓度,需要加入氯化氢,其质量为:0.365g;
故答案为:112;氯化氢;0.365;
(6)电解食盐水产生氢氧化钠:2NaCl+2H2O 2NaOH+H2↑+Cl2↑,氢氧化钠能和镁离子反应生成沉淀:2OH-+Mg2+=Mg(OH)2↓,
2NaOH+H2↑+Cl2↑,氢氧化钠能和镁离子反应生成沉淀:2OH-+Mg2+=Mg(OH)2↓,
故答案为:溶液中出现白色沉淀;2Cl-+2H2O 2OH-+H2↑+Cl2↑;2OH-+Mg2+=Mg(OH)2↓.
2OH-+H2↑+Cl2↑;2OH-+Mg2+=Mg(OH)2↓.
分析:(1)欲除去溶液I中的Mg2+、Ca2+、SO42-,则用氢氧化镁除掉Mg2+,用氯化钡除掉SO42-,用碳酸钠除掉Ca2+与多余的Ba2+,根据流程图可知试剂丙为碳酸钠;其作用为除掉掉Ca2+与多余的Ba2+;
(2)根据溶液C中的成分为碳酸钠、氢氧化钠、氯化钠、氯化钾来分析;
(3)根据溶液D中的成分为:氯化钠、氯化钾和过量的盐酸,操作甲为降温结晶来分析;
(4)根据电解饱和食盐水得到氢氧化钠、氢气、氯气,氢气在氯气中燃烧火焰呈苍白色;
(5)根据2NaCl+2H2O 2NaOH+Cl2↑+H2↑来计算,若要恢复浓度,则通入氯化氢即可,其质量等于氢气和氯气的质量之和;
2NaOH+Cl2↑+H2↑来计算,若要恢复浓度,则通入氯化氢即可,其质量等于氢气和氯气的质量之和;
(6)根据溶液中的镁离子能和碱反应生成沉淀.
点评:本题主要考查了粗盐的提纯、电解饱和食盐水,涉及到物质的除杂和提纯,化学计算等,难度中等,试题综合性较大.
(2)溶液C中的成分为碳酸钠、氢氧化钠、氯化钠、氯化钾,能与盐酸反应的有碳酸钠、氢氧化钠,离子方程式为:CO32-+2H+═H2O+CO2↑,H++OH-=H2O,
故答案为:CO32-+2H+═H2O+CO2↑,H++OH-=H2O;
(3)根据溶液D中的成分为:氯化钠、氯化钾和过量的盐酸,操作甲为降温结晶,溶液E中含有氯化钠、氯化钾和过量的盐酸,含有的离子有:Na+、K+、H+、OH-、Cl-,
故答案为:Na+、K+、H+、OH-、Cl-.
(4)根据电解饱和食盐水得到氢氧化钠、氢气、氯气,氢气在氯气中燃烧火焰呈苍白色,故答案为:苍白色;H2+Cl2
 2HCl;
2HCl;(5)溶液的pH值为13,c(OH-)=0.1mol/L,n(NaOH)=cV=0.1mol/L×0.1L=0.01mol
2NaCl+2H2O
 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑2 1 1
0.01mol n(Cl2) n(H2)
n(Cl2)=0.005mol n(H2)=0.005mol
阴极产生的氢气的体积n(氢气)=0.005mol×22.4L/mol=0.112L=112mL,
m(Cl2)+m(H2)=0.005mol×71g/mol+0.005mol×2g/mol=0.365g,
所以若恢复原溶液的成分和浓度,需要加入氯化氢,其质量为:0.365g;
故答案为:112;氯化氢;0.365;
(6)电解食盐水产生氢氧化钠:2NaCl+2H2O
 2NaOH+H2↑+Cl2↑,氢氧化钠能和镁离子反应生成沉淀:2OH-+Mg2+=Mg(OH)2↓,
2NaOH+H2↑+Cl2↑,氢氧化钠能和镁离子反应生成沉淀:2OH-+Mg2+=Mg(OH)2↓,故答案为:溶液中出现白色沉淀;2Cl-+2H2O
 2OH-+H2↑+Cl2↑;2OH-+Mg2+=Mg(OH)2↓.
2OH-+H2↑+Cl2↑;2OH-+Mg2+=Mg(OH)2↓.分析:(1)欲除去溶液I中的Mg2+、Ca2+、SO42-,则用氢氧化镁除掉Mg2+,用氯化钡除掉SO42-,用碳酸钠除掉Ca2+与多余的Ba2+,根据流程图可知试剂丙为碳酸钠;其作用为除掉掉Ca2+与多余的Ba2+;
(2)根据溶液C中的成分为碳酸钠、氢氧化钠、氯化钠、氯化钾来分析;
(3)根据溶液D中的成分为:氯化钠、氯化钾和过量的盐酸,操作甲为降温结晶来分析;
(4)根据电解饱和食盐水得到氢氧化钠、氢气、氯气,氢气在氯气中燃烧火焰呈苍白色;
(5)根据2NaCl+2H2O
 2NaOH+Cl2↑+H2↑来计算,若要恢复浓度,则通入氯化氢即可,其质量等于氢气和氯气的质量之和;
2NaOH+Cl2↑+H2↑来计算,若要恢复浓度,则通入氯化氢即可,其质量等于氢气和氯气的质量之和;(6)根据溶液中的镁离子能和碱反应生成沉淀.
点评:本题主要考查了粗盐的提纯、电解饱和食盐水,涉及到物质的除杂和提纯,化学计算等,难度中等,试题综合性较大.

练习册系列答案
 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案
相关题目



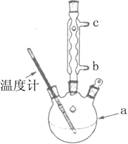
 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:

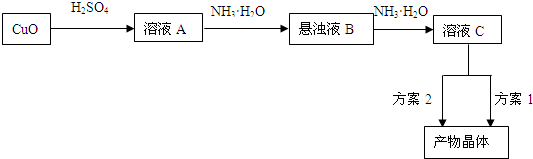
 Cu2++4NH3
Cu2++4NH3