题目内容
15.利用如图所示装置进行下列实验,能得出相应实验结论的是( )| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 浓盐酸 | MnO2 | NaBr溶液 | 氧化性Cl2>Br2 | |
| B | 浓氨水 | 生石灰 | AlCl3溶液 | Al(OH)3具有两性 | |
| C | 浓硫酸 | Na2SO3 | FeCl3溶液 | SO2具有还原性 | |
| D | 醋酸 | Na2CO3 | Na2SiO3 | 非金属性:C>Si |
| A. | A | B. | B | C. | C | D. | D |
分析 由图可知,①②组成的装置为固体与液体反应不需要加热装置制备气体,由③可知气体极易溶于水,易发生倒吸,则球形干燥管可防止倒吸,在烧杯中发生气体的性质实验,以此来解答.
解答 解:A.浓盐酸与二氧化锰反应需要加热,则不能制备氯气,故A不选;
B.浓氨水与生石灰反应制取氨气,氨气与氯化铝反应生成沉淀,但沉淀不能溶解,不能证明氢氧化铝的两性,故B不选;
C.浓硫酸与亚硫酸钠反应生成二氧化硫,二氧化硫与FeCl3溶液发生氧化还原反应生成硫酸根离子,S元素的化合价升高,SO2具有还原性,故C正确;
D.醋酸与碳酸钠反应生成二氧化碳,但醋酸易挥发,在烧杯中可发生醋酸与硅酸钠的反应,则不能比较C、Si的非金属性,故D错误;
故选C.
点评 本题考查化学实验方案的评价及实验装置的应用,为高频考点,涉及常见气体的制备原理、性质实验等,把握物质的性质、反应原理、实验基本操作等为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案
相关题目
5. 实验室用图所示装置电解氯化铜溶液,实验中观察到碳(I)电极质量增加,碳(II)电极有气体放出.下列说法正确的是( )
实验室用图所示装置电解氯化铜溶液,实验中观察到碳(I)电极质量增加,碳(II)电极有气体放出.下列说法正确的是( )
 实验室用图所示装置电解氯化铜溶液,实验中观察到碳(I)电极质量增加,碳(II)电极有气体放出.下列说法正确的是( )
实验室用图所示装置电解氯化铜溶液,实验中观察到碳(I)电极质量增加,碳(II)电极有气体放出.下列说法正确的是( )| A. | a为电源正极 | B. | 电极Ⅱ上发生还原反应 | ||
| C. | 电子流向:a→Ⅰ→Ⅱ→b | D. | 该装置将电能转化为化学能 |
6.某研究性学习小组的同学对实验室里久置于空气中变质的过氧化钠(Na2O2)固体的成分进行探究.
【查阅资料】
(1)Na2O2化学性质很活泼,能与水、二氧化碳反应,相关化学方程式为:2Na2O2+2H2O=4NaOH+O2↑;2Na2O2+2CO2=2Na2CO3+O2.
(2)Na2CO3溶液与中性的CaCl2溶液能发生复分解反应.
【猜想】
Ⅰ:固体为Na2O2、NaOH、Na2CO3的混合物
Ⅱ:固体为NaOH和Na2CO3的混合物
Ⅲ:固体为NaOH
Ⅳ:固体为Na2CO3
【实验探究】
【反思评价】固体Na2O2应密封保存.
【查阅资料】
(1)Na2O2化学性质很活泼,能与水、二氧化碳反应,相关化学方程式为:2Na2O2+2H2O=4NaOH+O2↑;2Na2O2+2CO2=2Na2CO3+O2.
(2)Na2CO3溶液与中性的CaCl2溶液能发生复分解反应.
【猜想】
Ⅰ:固体为Na2O2、NaOH、Na2CO3的混合物
Ⅱ:固体为NaOH和Na2CO3的混合物
Ⅲ:固体为NaOH
Ⅳ:固体为Na2CO3
【实验探究】
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量固体于试管中,加水振荡, 直至完全溶解. | 无气泡产生 | 猜想Ⅰ不成立 |
| ②取少量①中的溶液于试管中, 滴加CaCl2溶液. | 产生白色沉淀 | 证明有Na2CO3存在 |
| ③ 取少量①中的溶液于试管中,加入过量CaCl2溶液使沉淀完全,静置后,向上层清液中滴加酚酞试液. | 酚酞试液变红 | 证明有NaOH存在 |
| 综合以上实验现象,说明猜想Ⅱ是成立的. | ||
3.治理氮氧化物污染的方法之一是用NaOH溶液进行吸收,反应原理如下:NO2+NO+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO2+NaNO3+H2O.某学生在实验室用一定量的铜与足量的硝酸反应,收集到标准状况下NO、NO2和N2O4的混合气体共aL.若将上述混合气体通入1L 1mol/L的NaOH溶液中恰好被完全吸收.下列分析错误的是( )
| A. | 11.2L<a<22.4L | |
| B. | 若a=16.8L,V(N2O4)=5.6L | |
| C. | 若a=16.8L,n(NaNO2):n(NaNO3)=4:1 | |
| D. | 若混合气体与NaOH溶液反应只生成一种盐,则n(NO)=0.5mol |
10.设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,11.2LH2O含有的分子数为0.5NA | |
| B. | 0.1mol白磷(P4)所含的共价键数目为0.4 NA | |
| C. | 在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,每生成4mol Cl2转移的电子数为7NA | |
| D. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol/L |
20.如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.下列说法正确的是( )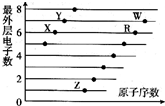

| A. | ZY、ZW的水溶液都显酸性 | |
| B. | 原子半径大小:W>R>X,离子半径大小:Z+>R2->W->Y- | |
| C. | W的氢化物水溶液的酸性比R的氢化物水溶液的酸性强,可证明非金属性:W>R | |
| D. | Z、X两种元素形成的Z2X、Z2X2为离子化合物 |
7.用相对分子质量为43的烷基取代烷烃(C4H10)分子中的一个氢原子,所得的有机物有(不考虑立体异构)( )
| A. | 4种 | B. | 5种 | C. | 7种 | D. | 8种 |
4.X、Y、Z、W是原子序数依次增大的短周期元素.已知X原子的最外层电子数是其所在周期数的2倍,X单质在Y单质中充分燃烧生成其最髙价化合物XY2,Z+与Y2-具有相同的电子数,W与Y同主族.下列说法正确的是( )
| A. | W在元素周期表中位于笫三周期笫IVA族 | |
| B. | X的最简单气态氢化物的热稳定性比Y的强 | |
| C. | 由X、Y、Z三种元素组成的物质水溶液一定呈碱性 | |
| D. | 由Y、Z两种元素组成的离子化合物,其阳离子与阴离子个数比不一定为2:1 |
5.A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,辛是由C元素形成的单质.已知:甲+乙=丁+辛,甲+丙=戊+辛;常温下0.l mol•L-1丁溶液的pH为13.下列说法正确的是( )
| A. | 元素B在周期表中的位置为第二周期第VIA族 | |
| B. | 元素B、C、D的原子半径由大到小的顺序为r(D)>r(C)>r(B) | |
| C. | 1 mol甲与足量的乙完全反应共转移了约6.02×1023个电子 | |
| D. | 1.0L 0.lmol-L-1戊溶液中阴离子总的物质的量小于0.l mol |