题目内容
【题目】下列说法正确的是( )。
A.在离子化合物中,只存在离子键,没有共价键
B.非极性键只存在于双原子的单质分子(如![]() )中
)中
C.原子序数为11与9的元素能够形成离子化合物
D.由不同元素组成的含多个原子的分子中,只存在极性键
【答案】C
【解析】
A.在离子化合物中,一定存在离子键,可能含有共价键,例如氢氧化钾,故A错误;
B.非极性键可以存在于多原子的化合物分子中,如H2O2中氧原子间形成非极性键,故B错误;
C.原子序数为11与9的元素分别为Na元素和F元素,Na是活泼金属,F是活泼非金属,所以会形成离子化合物,故C正确;
D.由不同元素组成的含多个原子的分子中,可以存在非极性键,如H2O2中氧原子间形成非极性键,故D错误;
答案选C。

【题目】铜及其化合物在工农业生产及日常生活中应用非常广泛.某研究小组用粗铜![]() 含杂质铁
含杂质铁![]() 制备氯化铜晶体
制备氯化铜晶体![]()
![]() 的流程如下:
的流程如下:

已知常温下,![]() 、
、![]() 的氢氧化物开始沉淀和沉淀完全时的pH见下表:
的氢氧化物开始沉淀和沉淀完全时的pH见下表:
金属离子 |
|
|
氢氧化物开始沉淀时的pH |
|
|
氢氧化物完全沉淀时的pH |
|
|
请回答下列问题:
![]() 溶液I中加入试剂X可以调节溶液pH,从而除去
溶液I中加入试剂X可以调节溶液pH,从而除去![]() 且不引入杂质。
且不引入杂质。
![]() 试剂X可选用下列物质中的______
试剂X可选用下列物质中的______![]() 填代号
填代号![]() 。
。
![]()
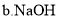
![]()
![]()
![]() 调节溶液pH时,理论上可选择pH最大范围是______。
调节溶液pH时,理论上可选择pH最大范围是______。
![]() 由溶液Ⅱ制备
由溶液Ⅱ制备![]() 的操作依次为:边滴加浓盐酸边加热浓缩、______
的操作依次为:边滴加浓盐酸边加热浓缩、______![]() 填操作名称
填操作名称![]() 、过滤、洗涤干燥。
、过滤、洗涤干燥。
![]() 室温下,将NaOH溶液逐滴加入到浓度均为
室温下,将NaOH溶液逐滴加入到浓度均为![]() 的
的![]() 和
和![]() 混合溶液中,先生成的沉淀是______
混合溶液中,先生成的沉淀是______![]() 室温时
室温时![]() ,
,![]() 。
。
![]() 某学习小组用碘量法测定
某学习小组用碘量法测定![]() 样品的纯度
样品的纯度![]() 杂质不与发生反应
杂质不与发生反应![]() 实验如下:
实验如下:
![]() 准确称取
准确称取![]() 样品mg于小烧杯中,加入适量蒸馏水和足量的碘化钾,再滴入适量的稀硫酸,充分反应后,将所得混合液配成250mL待测溶液。
样品mg于小烧杯中,加入适量蒸馏水和足量的碘化钾,再滴入适量的稀硫酸,充分反应后,将所得混合液配成250mL待测溶液。![]() 已知:
已知:![]()
![]() 移取
移取![]() 待测溶液于锥形瓶中,加几滴指示剂,用c
待测溶液于锥形瓶中,加几滴指示剂,用c![]() 标准液滴定至终点,重复2次,测得消耗标准液体积的平均值为V
标准液滴定至终点,重复2次,测得消耗标准液体积的平均值为V![]() 。(已知:
。(已知:![]() )
)
![]() 实验中使用的指示剂名称为______,达到滴定终点时的溶液颜色变化为______。
实验中使用的指示剂名称为______,达到滴定终点时的溶液颜色变化为______。
![]() 该样品中
该样品中![]() 的质量分数为______
的质量分数为______![]() 用含m、c、V的代数式表示,不用化简
用含m、c、V的代数式表示,不用化简![]() 。
。
【题目】利用如图所示装置进行以下实验,能得到相应实验结论的是
① | ② | ③ | 实验结论 |
| |
A | 浓氨水 | NaOH | 酚酞 | NaOH的碱性比 NH3H2O的强 | |
B | 浓盐酸 | MnO2 | 淀粉溶液 | 非金属性:氯元素大于碘元素 | |
C | 浓硝酸 | Na2CO3 | Na2SiO3 | 酸性:HNO3 > H2CO3 > H2SiO3 | |
D | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
A.AB.BC.CD.D