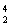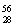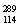题目内容
已知2 mol氢气完全燃烧生成水蒸气时放出能量484 kJ,且氧气中1 mol O===O键完全断裂时吸收能量496 kJ,水蒸气中1 mol H—O键形成时放出能量463 kJ,则氢气中1 mol H—H键断裂时吸收能量为( )。
A.920 kJB.557 kJC.436 kJ D.188 kJ
C
【解析】设1 mol H—H键断裂时吸收能量为x kJ。首先写出化学反应方程式2H2+O2 2H2O,然后分析过程,2H-H+O===O
2H2O,然后分析过程,2H-H+O===O 2H—O—H,由过程可知2 mol氢气完全燃烧生成水蒸气时应该拆开2 mol H—H键、1 mol O===O键,吸收的能量为(2x+496)kJ;生成2 mol H2O形成4 mol H—O键,放出的能量为4×463 kJ=1 852 kJ,依据能量守恒定律放出能量484 kJ=1 852 kJ-(2x+496)kJ,即可求出x=436。
2H—O—H,由过程可知2 mol氢气完全燃烧生成水蒸气时应该拆开2 mol H—H键、1 mol O===O键,吸收的能量为(2x+496)kJ;生成2 mol H2O形成4 mol H—O键,放出的能量为4×463 kJ=1 852 kJ,依据能量守恒定律放出能量484 kJ=1 852 kJ-(2x+496)kJ,即可求出x=436。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
标号为①~⑩的元素,在元素周期表中的位置如下:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① |
|
|
|
|
|
| ② |
2 |
|
|
| ③ | ④ | ⑤ | ⑥ |
|
3 | ⑦ | ⑧ |
|
|
| ⑨ | ⑩ |
|
试回答下列问题:
(1)其原子只要形成一对共用电子对就达到了稳定结构的元素是________。(填写元素符号)
(2)①和④号元素形成的化合物的化学式为________,用电子式表示其形成过程为________。
(3)⑧号元素的最高价氧化物的水化物的化学式是____________________。
(4)①、⑤、⑦号元素形成的一种化合物的电子式是________,在该化合物中既含有________键,又含有________键。