题目内容
7.关于阿伏伽德罗常数NA,下列说法正确的是( )| A. | 常温常压下,1mol白磷中含有共价键为4NA | |
| B. | 标准状况下,22.4L甲醇完全燃烧产生NA个CO2分子 | |
| C. | 常温常压下,46g NO2、N2O4混合物中,分子数为NA | |
| D. | 常温常压下,32g的O2 和32g的O3 所含的氧原子个数均为2NA |
分析 A、白磷中含6条共价键;
B、标况下甲醇为液态;
C、NO2、N2O4的摩尔质量不同;
D、氧气和臭氧均由氧原子构成.
解答 解:A、白磷中含6条共价键,故1mol白磷中含6NA条共价键,故A错误;
B、标况下甲醇为液态,故不能根据气体摩尔体积来计算其物质的量,故B错误;
C、NO2、N2O4的摩尔质量不同,故46g混合物的物质的量无法计算,故C错误;
D、氧气和臭氧均由氧原子构成,故32g氧气和32g臭氧中含有的氧原子的物质的量均为2mol,个数均为2NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
17.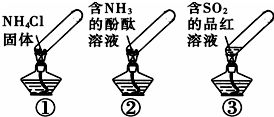 “封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )
 “封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )| A. | 加热时,①上部汇集了固体NH4Cl,说明NH4Cl的热稳定性比较好 | |
| B. | 加热时,②溶液褪色或红色变浅,冷却后又都变为红色 | |
| C. | 加热时,③溶液褪色或红色变浅,冷却后又都变为红色 | |
| D. | 三个“封管实验”中所发生的化学反应都是可逆反应 |
15.下列各对物质中,互为同分异构体的是( )
| A. | CH3-CH2-CH3和CH3-CH2-CH2-CH3 | B. |  | ||
| C. |  | D. |  |
12.设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 一定温度下,15g甲醛和乙酸的混合物中O原子数为0.5NA | |
| B. | pH=1的稀硫酸中含有的H+数为0.1NA | |
| C. | 133g氯化铝分子中含有铝离子的个数为NA | |
| D. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA |
19. 三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,110℃时失去全部结晶水.某实验小组为测定该晶体中铁的含量,做了如下实验,完成下列填空:
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,110℃时失去全部结晶水.某实验小组为测定该晶体中铁的含量,做了如下实验,完成下列填空:
步骤一:称取5.0g三草酸合铁酸钾晶体,配制成250mL溶液.
步骤二:取所配溶液25.00mL于锥形瓶中,加H2SO4酸化,滴加KMnO4溶液,发生反应
2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O(Mn2+视为无色).向反应后的溶液中加入锌粉,
加热至黄色刚好消失,过滤并洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶
液仍呈酸性.
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,滴定中MnO4-被还原成Mn2+.消耗KMnO4溶液体积如下表所示:
(1)步骤一所用仪器已有托盘天平(带砝码)、玻璃棒、烧杯、药匙,还缺少的仪器250mL容量瓶、胶头滴管.
(2)加入锌粉的目的是将Fe3+恰好还原成Fe2+.
(3)写出步骤三中发生反应的离子方程式5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O.
(4)实验测得该晶体中铁元素的质量分数为11.2%.在步骤二中,若滴加的KMnO4溶液的量不够,
则测得铁的含量偏高.(选填“偏低”、“偏高”或“不变”)
 三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,110℃时失去全部结晶水.某实验小组为测定该晶体中铁的含量,做了如下实验,完成下列填空:
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,110℃时失去全部结晶水.某实验小组为测定该晶体中铁的含量,做了如下实验,完成下列填空:步骤一:称取5.0g三草酸合铁酸钾晶体,配制成250mL溶液.
步骤二:取所配溶液25.00mL于锥形瓶中,加H2SO4酸化,滴加KMnO4溶液,发生反应
2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O(Mn2+视为无色).向反应后的溶液中加入锌粉,
加热至黄色刚好消失,过滤并洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶
液仍呈酸性.
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,滴定中MnO4-被还原成Mn2+.消耗KMnO4溶液体积如下表所示:
| 滴定次数 | 滴定起始读数(mL) | 滴定终点读数(mL) |
| 第一次 | 1.08 | 如图 |
| 第二次 | 2.02 | 24.52 |
| 第三次 | 1.00 | 20.98 |
(2)加入锌粉的目的是将Fe3+恰好还原成Fe2+.
(3)写出步骤三中发生反应的离子方程式5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O.
(4)实验测得该晶体中铁元素的质量分数为11.2%.在步骤二中,若滴加的KMnO4溶液的量不够,
则测得铁的含量偏高.(选填“偏低”、“偏高”或“不变”)
16.化学家创造出一种物质“干水”,其每个颗粒含水95%,外层是SiO2,干水吸收二氧化碳的能力比普通清水高三倍.下列有关说法正确的是( )
| A. | 干水和干冰是同一种物质 | |
| B. | 干水是纯净物 | |
| C. | 用干水吸收CO2有助于减缓温室效应 | |
| D. | 干水吸收CO2的过程只发生物理变化 |
17.化学与生活、生产密切相关.下列食品添加剂中,其使用目的与反应速率有关的是( )
| A. | 调味剂 | B. | 防腐剂 | C. | 增稠剂 | D. | 着色剂 |
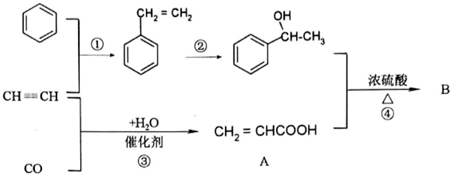
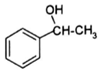 +CH2=CHCOOH$?_{△}^{浓H_{2}SO_{4}}$
+CH2=CHCOOH$?_{△}^{浓H_{2}SO_{4}}$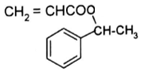 +H2O.
+H2O.