题目内容
短周期主族元素A、B、C、D,原子序数依次增大.A、B、C三种元素原子的最外层电子数之和为15,A、C的原子序数之差为8,A原子最外层电子数等于B原子最外层电子数的2倍.下列叙述正确的是( )
| A、非金属性:C>D |
| B、原子半径:A<D<C<B |
| C、氢化物的热稳定性:C>A |
| D、单质B常温下不能溶于浓硝酸但能溶于氢氧化钠溶液 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:短周期主族元素A、B、C、D的原子序数依次增大,A原子最外层电子数等于B原子最外层电子数的2倍,则A不可能处于第一周期,A、C的原子序数的差为8,说明A、C同主族,A原子最外层电子数等于B原子最外层电子数的2倍,令B的最外层电子数为x,则A、C最外层电子数为2x,则x+2x+2x=15,解得x=3,故A、C最外层电子数为6,再根据短周期元素A、B、C、D的原子序数依次递增,则A为氧元素,B为铝元素,C为硫元素,D为氯元素,据此解答.
解答:
解:短周期主族元素A、B、C、D的原子序数依次增大,A原子最外层电子数等于B原子最外层电子数的2倍,则A不可能处于第一周期,A、C的原子序数的差为8,说明A、C同主族,令B的最外层电子数为x,则A、C最外层电子数为2x,则x+2x+2x=15,解得x=3,故A、C最外层电子数为6,再根据短周期元素A、B、C、D的原子序数依次递增,则A为氧元素,B为铝元素,C为硫元素,D为氯元素,
A.C为硫元素,D为氯元素,同周期自左而右非金属性增强,故非金属性S<Cl,故A错误;
B.同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径O<Cl<S<Al,故B正确;
C.非金属性O>S,故氢化物稳定性:H2O>H2S,故C错误;
D.常温下Al在浓硝酸中发生钝化现象,不能溶于浓硝酸,但Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,故D正确,
故选:BD.
A.C为硫元素,D为氯元素,同周期自左而右非金属性增强,故非金属性S<Cl,故A错误;
B.同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径O<Cl<S<Al,故B正确;
C.非金属性O>S,故氢化物稳定性:H2O>H2S,故C错误;
D.常温下Al在浓硝酸中发生钝化现象,不能溶于浓硝酸,但Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,故D正确,
故选:BD.
点评:本题考查结构性质位置关系应用,推断元素是解题关键,注意掌握微粒半径、金属性非金属性强弱比较.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案
相关题目
下列有关化学用语表示正确的是( )
| A、乙酸的结构简式:C2H4O2 |
| B、中子数为20的氯原子:2017Cl |
C、S2-的结构示意图: |
D、NH3 的电子式: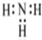 |
设NA表示阿伏加德罗常数,则下列说法中正确的是( )
| A、含Fe(OH)3为1mol的氢氧化铁胶体分散系中,分散质的粒子个数为NA |
| B、0.5mol 钠与氯气发生反应转移的电子数为NA |
| C、同温同压下,分子数相同的氧气和氮气所占体积也一定相同 |
| D、在标准状况下,4.48L CCl4中所含的原子总数为NA |
X、Y、Z均是短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-离子具有相同的电子层结构.下列说法不正确的是( )
| A、原子最外层电子数:Z>X>Y |
| B、氢化物的稳定性:Z>X |
| C、离子半径:X2->Y+>Z- |
| D、原子序数:X>Y>Z |
据报道,核素
Cs是核反应堆内核裂变的福产品之一.该核素原子核内中子数为( )
137 55 |
| A、27 | B、55 | C、82 | D、137 |
海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是( )
| A、利用蒸馏原理从海水中提取淡水是海水淡化技术发展的新方向 |
| B、因海水中含有镁元素,故不需经过化学变化就可以得到镁单质 |
| C、从海水中可得到NaCl,电解熔融NaCl或NaCl的水溶液都可制得Cl2 |
| D、无论是海水波浪发电还是潮汐发电,都是将化学能转化为电能 |
下列过程或现象中与盐类水解无关的是( )
| A、用纯碱溶液去油污 |
| B、久置的石灰水失效 |
| C、加热氯化铁溶液颜色变深 |
| D、浓硫化钠溶液有臭味 |
