题目内容
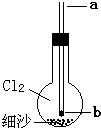 如图所示实验装置,烧瓶内充满氯气,底部有一层细沙(不参与反应),玻璃导管下口b处塞有一小块钠.从a口伸入一根细铁丝把钠块捅下去,再用滴管从a口滴下一滴水,恰好落在钠块上,立即剧烈反应.
如图所示实验装置,烧瓶内充满氯气,底部有一层细沙(不参与反应),玻璃导管下口b处塞有一小块钠.从a口伸入一根细铁丝把钠块捅下去,再用滴管从a口滴下一滴水,恰好落在钠块上,立即剧烈反应.
下列对此实验的说法中,不正确的是
- A.所充氯气应用向上排空气法收集
- B.反应中,烧瓶内产生大量白色烟雾
- C.玻璃导管只起到定位加入钠和水的作用
- D.烧瓶中Cl2,可能参与四个氧化还原反应
C
分析:A、根据氯气的密度选择排空气收集方法;
B、钠与水反应放出大量的热使钠与氯气反应生成氯化钠固体颗粒,同时有HCl生成;
C、反应导致气体的物质的量减小,玻璃导管可以平衡烧瓶内外压强;
D、滴加水由氢氧化钠与氢气生成,氯气可以与钠反应、与水反应、与氢氧化钠反应、与氢气反应.
解答:A、氯气的密度比空气的密度大,通常条件不与氧气等反应,故选择向上排空气法收集,故A正确;
B、钠与水反应放出大量的热使钠与氯气反应生成氯化钠固体颗粒,有HCl生成,与水蒸气结合,故为白色烟雾,故B正确;
C、反应导致气体的物质的量减小,玻璃导管可以平衡烧瓶内外压强,防止发生危险,故C错误;
D、滴加水由氢氧化钠与氢气生成,氯气可以与钠反应、与水反应、与氢氧化钠反应、与氢气反应,都属于氧化还原反应,故D正确;
故选C.
点评:本题考查氯气、钠的性质等,难度中等,C选项为易错点、难点,注意基础知识的理解掌握.
分析:A、根据氯气的密度选择排空气收集方法;
B、钠与水反应放出大量的热使钠与氯气反应生成氯化钠固体颗粒,同时有HCl生成;
C、反应导致气体的物质的量减小,玻璃导管可以平衡烧瓶内外压强;
D、滴加水由氢氧化钠与氢气生成,氯气可以与钠反应、与水反应、与氢氧化钠反应、与氢气反应.
解答:A、氯气的密度比空气的密度大,通常条件不与氧气等反应,故选择向上排空气法收集,故A正确;
B、钠与水反应放出大量的热使钠与氯气反应生成氯化钠固体颗粒,有HCl生成,与水蒸气结合,故为白色烟雾,故B正确;
C、反应导致气体的物质的量减小,玻璃导管可以平衡烧瓶内外压强,防止发生危险,故C错误;
D、滴加水由氢氧化钠与氢气生成,氯气可以与钠反应、与水反应、与氢氧化钠反应、与氢气反应,都属于氧化还原反应,故D正确;
故选C.
点评:本题考查氯气、钠的性质等,难度中等,C选项为易错点、难点,注意基础知识的理解掌握.

练习册系列答案
相关题目
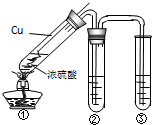
(16分)已知氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用。为了探究二氧化硫的漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,某学习小组设计了如下装置来进行实验。请回答相关问题。
(1)为了探究干燥的SO2能不能使品红褪色,某同学设计了如图所示实验装置,请指出实验装置图设计中的不合理之处。
① ; ② .
(2)按照修改后的装置,实验中控制二氧化硫以大约每秒3个气泡的速度通过品红的酒
精溶液时,经过一小时后,品红仍不褪色。这说明品红褪色的原因不是二氧化硫直接导
致。为此,SO2能使品红的水溶液褪色的可能微粒有 。
(3)甲同学实验如下:取等量、相同浓度的品红水溶液于两支试管中,再分别加入少量
亚硫酸钠固体和亚硫酸氢钠固体,两支试管中的品红都褪色,对此,他得出结论:使品
红褪色的微粒是HSO3-和SO32-,不是H2SO3。你认为他的结论是否正确 ,其理由
是 。
(4)为了进一步探究,乙组同学做了如下实验:分别取相同浓度的品红水溶液各20ml于两只小烧杯中,两只烧杯中同时一次性各加入20ml 0.1mol/L的亚硫酸钠,20ml 0.1mol/L的亚硫酸氢钠溶液,发现加入亚硫酸钠溶液的品红褪色较快。
①微粒浓度与褪色快慢关系,请用“多”或“少”填写“ ”内容。
| 同浓度溶液 | SO32- | HSO3- | H2SO3 | 褪色速度 |
| Na2SO3溶液 | 多 | 少 | 少 | 快 |
| NaHSO3溶液 | 较上面 | 较上面 | 较上面 | 慢 |
②根据实验和分析,得出的结论是 。
 化学是一门以实验为基础的自然科学.
化学是一门以实验为基础的自然科学. 已知氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用.为了探究二氧化硫的漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,某学习小组设计了如图装置来进行实验.请回答相关问题.
已知氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用.为了探究二氧化硫的漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,某学习小组设计了如图装置来进行实验.请回答相关问题.