题目内容
已知:H—H键能为436kJ/mol,Cl—Cl键能为247kJ/mol,H—Cl键能为431kJ/mol,现有反应![]() ,试讨论反应物
,试讨论反应物 、
、 与生成物HCl的键能与反应热的关系.
与生成物HCl的键能与反应热的关系.
解析:
|
反应热和键能的关系:反应热等于生成物的键能总和跟反应物键能总和之差. |

氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)已知:H—H键能为436 kJ·mol—1,N≡N键能为946 kJ·mol—1,N—H键能为391 kJ·mol—1。写出合成氨反应的热化学方程式:
(2)恒温下,往一个4L的密闭容器中充人5.2molH2和2molN2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol·L—1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
①5min内,消耗H2的平均反应速率为___________________________________
②N2的平衡转化率
③此条件下该反应的化学平衡常数K=__________________________。反应达到平衡后,若维持容器体积不变,温度不变,往平衡体系中加入H2、N2和NH3各8mol,化学平衡将向_______方向移动(填“正反应”或“逆反应”)。
④若维持容器体积不变,只升高温度化学平衡常数值 (填变大、变小、不变),正反应速率 (填变大、变小、不变)。
⑤若温度维持不变,只将容器体积由4L变为2L,达新平衡时N2的平衡浓度 0.4 mol·L—1(填大于、小与、等于)
氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)已知:H—H键能为436 kJ·mol—1,N≡N键能为946 kJ·mol—1,N—H键能为391 kJ·mol—1。写出合成氨反应的热化学方程式:
(2)恒温下,往一个4L的密闭容器中充人5.2molH2和2molN2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol·L—1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
①5min内,消耗H2的平均反应速率为___________________________________
②N2的平衡转化率
③此条件下该反应的化学平衡常数K=__________________________。反应达到平衡后,若维持容器体积不变,温度不变,往平衡体系中加入H2、N2和NH3各8mol,化学平衡将向_______方向移动(填“正反应”或“逆反应”)。
④若维持容器体积不变,只升高温度化学平衡常数值 (填变大、变小、不变),正反应速率 (填变大、变小、不变)。
⑤若温度维持不变,只将容器体积由4L变为2L,达新平衡时N2的平衡浓度 0.4 mol·L—1(填大于、小与、等于)
氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)已知:H—H键能为436 kJ·mol—1,N≡N键能为946 kJ·mol—1,N—H键能为391 kJ·mol—1。写出合成氨反应的热化学方程式:
(2)恒温下,往一个4L的密闭容器中充人5.2molH2和2molN2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol·L—1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
②N2的平衡转化率
③此条件下该反应的化学平衡常数K=__________________________。反应达到平衡后,若维持容器体积不变,温度不变,往平衡体系中加入H2、N2和NH3各8mol,化学平衡将向_______方向移动(填“正反应”或“逆反应”)。
④若维持容器体积不变,只升高温度化学平衡常数值 (填变大、变小、不变),正反应速率 (填变大、变小、不变)。
⑤若温度维持不变,只将容器体积由4L变为2L,达新平衡时N2的平衡浓度 0.4 mol·L—1(填大于、小与、等于)
氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)已知:H—H键能为436 kJ·mol—1,N≡N键能为946 kJ·mol—1,N—H键能为391 kJ·mol—1。写出合成氨反应的热化学方程式:
(2)恒温下,往一个4L的密闭容器中充人5.2molH2和2molN2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
|
时间/min |
5 |
10 |
15 |
20 |
25 |
30 |
|
c(NH3)/mol·L—1 |
0.08 |
0.14 |
0.18 |
0.20 |
0.20 |
0.20 |
①5min内,消耗H2的平均反应速率为___________________________________
②N2的平衡转化率
③此条件下该反应的化学平衡常数K=__________________________。反应达到平衡后,若维持容器体积不变,温度不变,往平衡体系中加入H2、N2和NH3各8mol,化学平衡将向_______方向移动(填“正反应”或“逆反应”)。
④若维持容器体积不变,只升高温度化学平衡常数值 (填变大、变小、不变),正反应速率 (填变大、变小、不变)。
⑤若温度维持不变,只将容器体积由4L变为2L,达新平衡时N2的平衡浓度 0.4 mol·L—1(填大于、小与、等于)
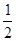 O2(g)===H2O(1) ΔH=-285.6kJ/mol
O2(g)===H2O(1) ΔH=-285.6kJ/mol