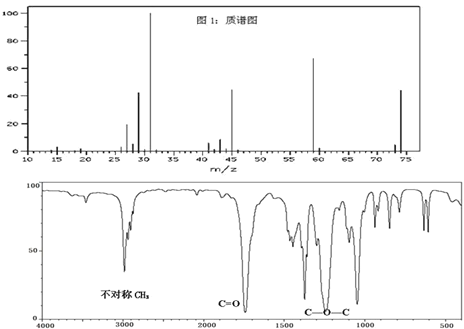
题目内容
【题目】亚硝酰氯(NOCl)是有机物合成中的重要试剂,为红褐色液体或黄色气体,室温下为不稳定的黄色气体, 具刺鼻恶臭味,遇水分解,某学习小组用 C12 和 NO 制备 NOCl 装置如图。下列说法错误的是
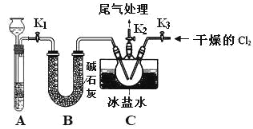
A.氯气在反应中做氧化剂
B.装入药品后,要先打开 K2、K3,反应一段时间后,再打开 K1
C.利用 A 装置还可以做 Na2O2 和水制氧气的实验
D.若没有 B 装置,C 中可能发生反应:2NOCl+H2O=2HCl+NO↑+NO2↑
【答案】C
【解析】
由装置A制备NO,用铜和稀硝酸反应制备,制得的NO中可能有挥发的硝酸,故装置B用来净化和干燥NO,将氯气和NO干燥后在装置C中发生反应,在冰盐中冷凝收集NOCl,氯气、NO以及NOCl均不能排放到空气中,用氢氧化钠溶液吸收,NOCl遇水易水解,故在收集装置和尾气处理装置之间应该需加一个干燥装置。
A. 根据Cl2和NO反应生成了NOCl,氯元素化合价降低,得电子,Cl2为氧化剂,故A正确;
B. 先打开K2、K3,通入一段时间氯气,排尽三颈烧瓶中的空气,防止NO、NOCl 变质,然后再打开K1,通入NO,故B正确;
C. 该装置能制备用块状固体和液体反应生成的气体,过氧化钠为粉末状固体,所以不可以做Na2O2和水制氧气的实验,故C错误;
D. 若无装置B,C中亚硝酰氯与水反应生成氯化氢、NO和二氧化氮,可能发生反应:2NOCl+H2O═2HCl+NO↑+NO2↑,故D正确;
故选:C。

练习册系列答案
相关题目