��Ŀ����
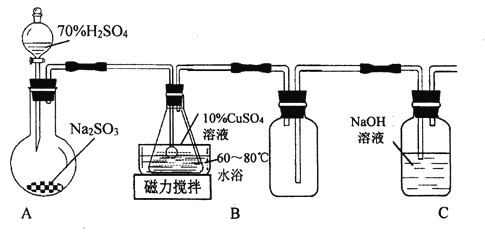
����Ŀ��л���ն��Σ�Cu2SO3��CuSO3��2H2O)��һ�ֲ�����ˮ������Ҵ��Ĺ��壬100��ʱ�����ֽ⡣����CuSO4��5H2O��SO2��Ϊԭ���Ʊ���ʵ��װ�D����ͼ��ʾ��
(1)װ��A�ڳ�������ȡSO2ʱ����70%���������ϡ�����98%Ũ���ᣬ��ԭ����________��
(2)װ��B�з�����Ӧ�����ӷ���ʽΪ_________��
(3)װ��C��������__________��
(4)��B�л�õĹ�������������ˮ���ϴ�ӣ�����ո�����鼺ϴ����ȫ�ķ�����________________��
(5)�벹�������ɹ�ҵ������ͭ��������FeO)�Ʊ�ʵ��ԭ�ϣ�����CuSO4��5H2O) ��ʵ�鷽������ҵ������ͭ�б߽�������Թ�����������Һ����ʹ����ȫ�ܽ⣬�߽���������е���______��Һ�������������________����3.2<pH<4.2�����ã����ˣ�����Һˮԡ��������Ũ����������־�Ĥ����ȴ�ᾧ�����ˣ���95% �ƾ�ϴ�Ӿ���2��3�Σ����ɣ��õ�CuSO4��5H2O��
[��֪������Һ���������↑ʼ�����������ȫʱ��pH��Χ�ֱ�Ϊ��Fe(OH)2 (5.8, 8.8); Cu(OH)2 (4.2, 6.7); Fe(OH)3 (1.1��3.2)]
���𰸡� ����������ϡ�����е��ܽ��̫��Ũ������H+Ũ��С���������Ʊ��������� 3Cu2++3SO2+6H2O= Cu2SO3��CuSO3��2H2O+8H++SO42- ����ȫƿ����ֹ���� ȡ�������һ�εĹ���Һ���Թ��У������еμ������ữ��BaCl2��Һ������������ɫ�������������ϴ����ȫ H2O2 CuO[�� Cu(OH)2 �� CuCO3�� Cu2(OH)2 CO3]
��������װ��A��Ũ��������������Ʊ�����������60����80�������£�������ͭ��Һ��װ��B�з�Ӧ����л���ն���(Cu2SO3CuSO32H2O)��Dװ����������δ��Ӧ��Ķ��������ж����壬��ֹ��Ⱦ������
(1)��������������ˮ����ϡ�����е��ܽ��̫��Ũ������H+Ũ��̫С���������Ʊ�����������70%���Ậˮ���٣�������ˮ�������ڶ��������������ʴ�Ϊ������������ϡ�����е��ܽ��̫��Ũ������H+Ũ��С���������Ʊ���������
(2)װ��B�з�������ͭ������������ɲ���Cu2SO3CuSO32H2O�ķ�Ӧ��ͭԪ�ػ��ϼ۽��͵�+1�ۣ��������������Ԫ�����۵�+6�ۣ���Ӧ�����ӷ���ʽΪ��3Cu2++3SO2+6H2O=Cu2SO3CuSO32H2O��+8H++SO42-���ʴ�Ϊ��3Cu2++3SO2+6H2O=Cu2SO3CuSO32H2O��+8H++SO42-��
(3)��������������ˮ��װ��C���Է��������ʴ�Ϊ������ȫƿ����ֹ������
(4)�ٲ�����δϴ�Ӹɾ�������溬����������ӣ�������������Ӽ��ɣ�������������ӵķ���Ϊ��ȡ�������һ�ε�ϴ�ӹ���Һ���Թ��У������еμ������ữ��BaCl2��Һ������������ɫ�����������������ϴ����ȫ���ʴ�Ϊ��ȡ�������һ�εĹ���Һ���Թ��У������еμ������ữ��BaCl2��Һ������������ɫ�������������ϴ����ȫ��
(5)�ɹ�ҵ������ͭ(������FeO)�Ʊ�ʵ��ԭ��(����CuSO45H2O)����ҵ������ͭ�б߽�������Թ�����������Һ����ʹ����ȫ�ܽ⣬�õ�����ͭ�����������Ļ����Һ���轫�������ӳ�ȥ��������Ŀ����Ϣ�����������Գ�����ʽ��ȥʱͭ��������ʧ������������ȫ����ʱ��ͭ��������ʧ����Ӧ�Ƚ�������������Ϊ�����ӣ����Dz����������ʣ�Ӧѡ��˫��ˮ���ٵ���pH�������ӳ������ʲ���Ϊ����ҵ������ͭ�б߽�������Թ�����������Һ����ʹ����ȫ�ܽ⣬�߽���������е���H2O2��Һ����������������CuO[��Cu(OH)2�� CuCO3�� Cu2(OH)2 CO3]����3.2��pH��4.2�����ã����ˣ�����Һˮԡ����������Ũ����������־�Ĥ����ȴ�ᾧ�����ˣ���95%�ƾ�ϴ�Ӿ���2��3�Σ����ɣ��õ�CuSO45H2O���ʴ�Ϊ��H2O2��CuO[��Cu(OH)2�� CuCO3�� Cu2(OH)2 CO3]��