题目内容
已知乙醇沸点78℃,能与水以任意比混溶.乙醚沸点34.6℃,极易燃烧,微溶于水,在饱和Na2CO3溶液中几乎不溶,而乙醇与饱和Na2CO3溶液仍互溶.今欲在实验室用乙醇制取乙醚,反应原理为:
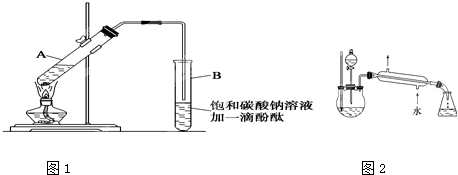
(1)甲和乙两位同学分别设计了图中甲、乙两套制取乙醚的装置,其中________装置更合适,理由是________.对该装置需要改进的地方是________.
(2)如果使用乙装置,则在其冷凝管处标上进出水方向(用箭头↑、↓表示);用乙装置收集的乙醚中可能含的杂质是________,除杂试剂是________,所用主要仪器是________.

答案:
解析:
提示:
解析:
答案:(1)乙,收集乙醚的容器温度低、离火源远,乙醚的收集率高、安全,向蒸馏烧瓶内加入几块沸石,将温度计的感温泡插入蒸馏烧瓶里的液体内
(2)略,乙醇,饱和Na2CO3溶液,分液漏斗
解析:(1)乙醚易挥发、易燃烧,从防火和提高乙醚收集率两个方面来说,都是乙比甲更合适.从表面上看,乙是一套蒸馏装置,温度计处没有错误.而更重要的是,由乙醇生成乙醚的化学反应是在140℃的温度下发生,因此要使温度计显示乙醇和浓硫酸混合物的温度,以利于控制反应物的温度.纯液体受热时易发生暴沸现象,沸石(或碎瓷片)可避免液体暴沸现象的发生.
(2)为了提高冷却的效果,冷却水要从冷凝管的下口进、上口出.乙醇的沸点为78℃,在140℃的温度下,乙醇除发生化学反应以外,也有一部分随着乙醚挥发.乙醇易溶于饱和Na2CO3溶液,而乙醚几乎不溶于饱和Na2CO3溶液,乙醚与乙醇、Na2CO3、水的混合物分层存在,可用分液法分离.
提示:
将题给信息与所学分离方法有机结合起来是解题关键,考查了自学能力和处理信息的能力.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O

