题目内容
4.下列说法正确的是( )| A. | 原子最外层电子数小于4的元素一定为金属元素 | |
| B. | 质子数等于电子数的某微粒,可能是一种分子或一种原子 | |
| C. | 第ⅠA族元素的金属性一定比第ⅡA族元素的金属性强 | |
| D. | 非金属元素形成的化合物只有共价化合物 |
分析 A、氢最外层只有1个电子;
B、分子或原子的质子数等于电子数,离子的质子数不等于电子数,质子数等于电子数的微粒不可能是一种分子和一种离子;
C、第IA族元素的金属性不一定比第IIA族元素的金属性强;
D、氯化铵是非金属元素形成的离子化合物.
解答 解:A、氢最外层只有1个电子,所以原子最外层电子数小于1的元素不一定为金属元素,故A错误;
B、分子或原子的质子数等于电子数,离子的质子数不等于电子数,质子数等于电子数的微粒不可能是一种分子和一种离子,所以可能是一种分子或一种原子,故B正确;
C.ⅠA族元素的金属性不一定比ⅡA族元素的金属性强,比如金属锂的金属性不如第IIA族的钡强,同周期ⅠA族元素的金属性一定比ⅡA族元素的金属性强,故C错误;
D、氯化铵是非金属元素形成的离子化合物,故D错误;
故选B.
点评 本题考查元素周期律,明确同一周期、同一主族元素性质递变规律是解本题关键,注意规律中的异常现象,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.以下实验能获得成功的是( )
| A. | 苯和硝基苯直接采用分液的方法分离 | |
| B. | 将铁屑、溴水、苯混合制溴苯 | |
| C. | 在溴乙烷中加入NaOH水溶液共热,然后加入稀硝酸至呈酸性,再滴入AgNO3溶液,通过观察有无浅黄色沉淀来检验溴乙烷中的溴元素 | |
| D. | 在蔗糖溶液中加入稀硫酸共热,然后加入银氨溶液水浴加热,通过观察有无银镜生成来检验蔗糖的水解产物中有无还原性糖 |
14.下列元素中不属于主族元素的是( )
| A. | 磷 | B. | 铁 | C. | 碘 | D. | 钙 |

 .
. .
. .
.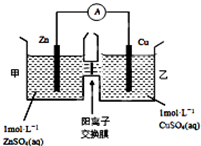 化学与人类生产和生活中密切相关,掌握有关的化学基础知识可以改善我们的生活.
化学与人类生产和生活中密切相关,掌握有关的化学基础知识可以改善我们的生活.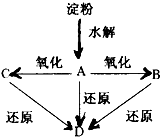 如图所示,淀粉水解可产生某有机化合物A,A在不同的氧化剂作用下可以生成B(C6H12O7)或C(C6H10O8),B和C都不能发生银镜反应.A、B、C都可以被强还原剂还原成为D(C6H14O6).已知,相关物质被氧化的难易次序是:RCHO最易,R-CH2OH次之,
如图所示,淀粉水解可产生某有机化合物A,A在不同的氧化剂作用下可以生成B(C6H12O7)或C(C6H10O8),B和C都不能发生银镜反应.A、B、C都可以被强还原剂还原成为D(C6H14O6).已知,相关物质被氧化的难易次序是:RCHO最易,R-CH2OH次之,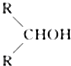 最难.
最难.