题目内容
已知SnCl4、SiCl4、AlCl3、PCl3等氯化物在潮湿的空气中打开瓶塞后,都有白雾生成.为清楚地观察磷在Cl2中燃烧,达到PCl3和PCl5分步生成的目的.可预先把干燥的Cl2贮存在100mL的注射器内,再把火柴头大小的红磷置于玻璃燃烧匙上烘干后,组成如图所示的装置.操作时打开弹簧夹,缓缓推动注射器的针塞,待磷燃烧出现白雾时,立即关闭弹簧夹,停止推入Cl2,片刻后,可见到试管内白雾凝成无色液滴附着在试管内壁.然后再打开弹簧夹,继续推入Cl2,就可看到管壁上液滴逐渐消失,管内出现白烟,最后白烟凝结成白色固体附着在试管内壁上.试回答:

(1)该实验选择玻璃燃烧匙,不选其他金属燃烧匙的原因是________;
(2)该实验的关键是,使用的Cl2和红磷必须干燥,(请用必要的文字和化学方程式说明原因)________;
(3)第二次推入Cl2时发生的反应是(用化学方程式表示)________,故第一次推入Cl2之所以要缓缓进行的原因是________.
答案:
解析:
解析:
|
(1)避免金属与Cl2反应,影响实验效果 (2)未作干燥时,其一是Cl2与H2O反应生成HCl、HClO,对实验有干扰;其二是生成的PCl3、PCl5要发生水解:PCl3+3H2O (3)PCl3+Cl2 |

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
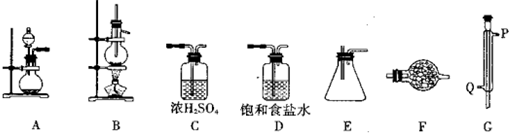
某化学研究性学习小组为了探究四氯化锡的有关性质,拟先利用下列装置和药品进行四氯化锡的制备.已知四氯化锡具有强的吸水性,SnCl4和Sn的部分数据如下
| 密度 | 熔点 | 沸点 | |
| 四氯化锡 | 2.2g?cm-3 | -33℃ | 114℃ |
| 金属锡 | 5.77g?cm-3 | 231℃ |

请回答下列相关问题:
(1)实验时装置的正确连接顺序为A→______→______→______→______→______→______;
(2)仪器G的名称是______;实验时,G中冷却水的流向是从______进入(填符号);
(3)A中发生反应的离子方程式为______;
(4)F中盛装的化学试剂是______;其作用是______;
(5)IVA族从上到下有C、Si、Ge、Sn、Pb等元素,请比较该族元素最高价氧化物对应水化物碱性的强弱顺序为(用化学式表示)______.
某化学研究性学习小组为了探究四氯化锡的有关性质,拟先利用下列装置和药品进行四氯化锡的制备.已知四氯化锡具有强的吸水性,SnCl4和Sn的部分数据如下
供选择的药品:Sn、浓HC1、稀HCl、浓H2SO4、MnO2、KMnO4、无水CaCl2、碱石灰仪器装置:

请回答下列相关问题:
(1)实验时装置的正确连接顺序为A→ → → → → → ;
(2)仪器G的名称是 ;实验时,G中冷却水的流向是从 进入(填符号);
(3)A中发生反应的离子方程式为 ;
(4)F中盛装的化学试剂是 ;其作用是 ;
(5)IVA族从上到下有C、Si、Ge、Sn、Pb等元素,请比较该族元素最高价氧化物对应水化物碱性的强弱顺序为(用化学式表示) .
| 密度 | 熔点 | 沸点 | |
| 四氯化锡 | 2.2g?cm-3 | -33℃ | 114℃ |
| 金属锡 | 5.77g?cm-3 | 231℃ |

请回答下列相关问题:
(1)实验时装置的正确连接顺序为A→ → → → → → ;
(2)仪器G的名称是 ;实验时,G中冷却水的流向是从 进入(填符号);
(3)A中发生反应的离子方程式为 ;
(4)F中盛装的化学试剂是 ;其作用是 ;
(5)IVA族从上到下有C、Si、Ge、Sn、Pb等元素,请比较该族元素最高价氧化物对应水化物碱性的强弱顺序为(用化学式表示) .