题目内容
19.短周期元素X和Y,X原子的电子层数为n,最外层电子数为(2n+1),Y原子最外层电子数是次外层电子数的3倍.下列说法一定正确的是( )| A. | X和Y都是非金属元素,其中X的最高化合价为+5价 | |
| B. | X与Y所能形成的化合物都是酸性氧化物 | |
| C. | 元素X的氧化物的水化物是强酸 | |
| D. | X的氢化物极易溶于水,可以用来做喷泉实验 |
分析 短周期元素X和Y,X原子的电子层数为n,最外层电子数为(2n+1),X不可能有1个电子层,若X有2个电子层,则X为氮元素,若X有3个电子层,则X为氯元素;Y原子最外层电子数是次外层电子数的3倍,则Y有2个电子层,最外层电子数为6,故Y为氧元素,结合元素周期律与物质性质解答.
解答 解:短周期元素X和Y,X原子的电子层数为n,最外层电子数为(2n+1),X不可能有1个电子层,若X有2个电子层,则X为氮元素,若X有3个电子层,则X为氯元素;Y原子最外层电子数是次外层电子数的3倍,则Y有2个电子层,最外层电子数为6,故Y为氧元素.
A.X为氮元素或氯元素、Y为氧元素,都属于非金属,X若为氟元素没有正化合价,若X为氯元素,最高正化合价为+7价,故A错误;
B.X为氮元素或氯元素、Y为氧元素,X与Y形成的NO等不属于酸性氧化物,故B错误;
C.X为氮元素或氯元素,含氧酸中次氯酸等属于弱酸,故C错误;
D.氨气与氟化氢都易溶于水,可以用来做喷泉实验,故D正确.
故选D.
点评 本题考查结构与位置关系、元素化合物性质等,难度不大,注意利用短周期来分析X元素是解答本题的关键.

练习册系列答案
相关题目
10.下列鉴别方法可行的是( )
| A. | 用氨水鉴别MgCl2溶液和AlCl3溶液 | |
| B. | 用二氧化碳鉴别CaCl2溶液和NaCl溶液 | |
| C. | 用铁片鉴别稀H2SO4和浓H2SO4 | |
| D. | 用相互滴加的方法鉴别NaHCO3溶液和Ca(OH)2溶液 |
7.下列说法中,正确的是( )
| A. | s区元素都是金属元素 | B. | p区元素全部都是非金属元素 | ||
| C. | d区、ds区和f区由副族元素组成 | D. | s区和p区由主族和0族元素组成 |
14.下列说法中正确的是( )
| A. | 原子晶体中的各相邻原子都以共价键相结合 | |
| B. | 金属导电的原因是在外电场作用下金属产生自由电子,电子定向运动 | |
| C. | 分子晶体的熔沸点很低,常温下都呈液态或气态 | |
| D. | 离子晶体中每个离子周围均吸引着6个带相反电荷的离子 |
4.以下说法正确的是( )
| A. | 金属元素与非金属元素的原子间只形成离子键 | |
| B. | 原子或离子间相互的吸引力叫化学键 | |
| C. | 非金属元素间只能形成共价键 | |
| D. | 共价化合物内部可能有极性键和非极性键 |
11.已知烯烃在一定条件下氧化时,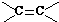 键断裂.如RCH═CHR′可氧化成RCHO和R′CHO,下列烯烃中,经氧化可得到乙醛和丁醛的是( )
键断裂.如RCH═CHR′可氧化成RCHO和R′CHO,下列烯烃中,经氧化可得到乙醛和丁醛的是( )
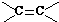 键断裂.如RCH═CHR′可氧化成RCHO和R′CHO,下列烯烃中,经氧化可得到乙醛和丁醛的是( )
键断裂.如RCH═CHR′可氧化成RCHO和R′CHO,下列烯烃中,经氧化可得到乙醛和丁醛的是( )| A. | 1-己烯 | B. | 2-己烯 | C. | 3-已烯 | D. | 2-甲基-2-戊烯 |
8.下列粒子半径比较中,正确的是( )
| A. | Na+<Mg2+<Al3+<K+ | B. | S2->Cl->K+>Ca2+ | ||
| C. | O2->S2->Cl->Br- | D. | F->Li+>Na+>S2- |
9.在四个不同的容器中,在不同的条件下进行合成氨反应,根据下列在相同时间内测得的结果判断,生成氨的反应速率最快的是( )
| A. | v(NH3)=0.3 mol/(L•min) | B. | v(N2)=0.01 mol/(L•s) | ||
| C. | v(N2)=0.2 mol/(L•min) | D. | v(H2)=0.3 mol/(L•min) |
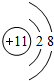 ,D元素位于周期表中的位置第三周期第ⅤⅡA族.
,D元素位于周期表中的位置第三周期第ⅤⅡA族.