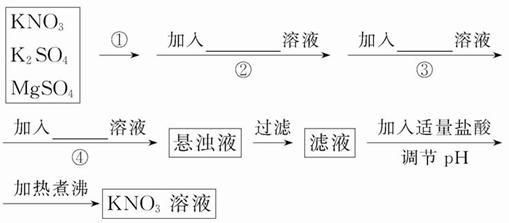
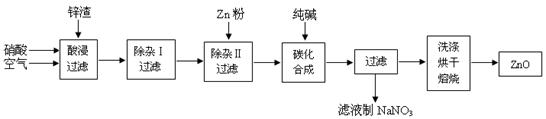
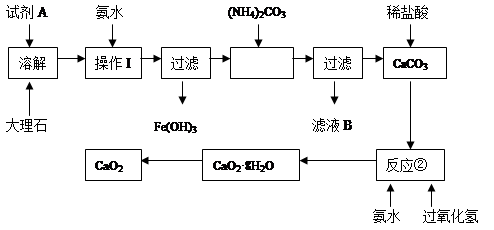
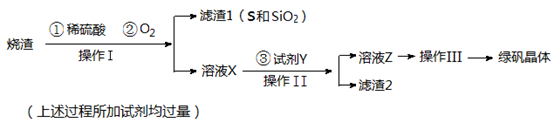
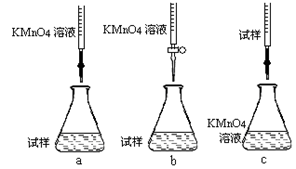
题目内容
实验室模拟回收某废旧含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)生产Ni2O3。其工艺流程为: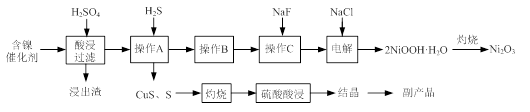
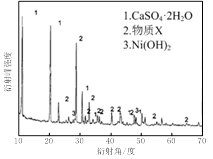
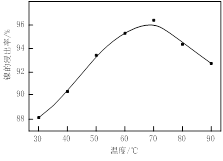
图Ⅰ 图Ⅱ
(1)根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为 。图Ⅱ表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是 。
(2)工艺流程中“副产品”的化学式为 。
(3)已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
操作B是为了除去滤液中的铁元素,某同学设计了如下实验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。请对该实验方案进行评价: (若原方案正确,请说明理由;若原方案错误,请加以改正)。
(4)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3 mol·L-1,则Ca2+的浓度为 mol·L-1。(常温时CaF2的溶度积常数为2.7×10-11)
(5)电解产生2NiOOH·H2O的原理分两步:①碱性条件下Cl-在阳极被氧化为ClO-;②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。第②步反应的离子方程式为 。
(1)BaSO4 温度升高,Ni2+的水解程度增大
(2)CuSO4·5H2O
(3)方案错误。在调节pH前,应先在滤液中加入H2O2,使溶液中的Fe2+氧化为Fe3+⑷3×10-6⑸ClO-+2Ni2++4OH-=2NiOOH·H2O+Cl-
解析试题分析:含镍催化剂与硫酸反应后,Ca2+和Ba2+形成沉淀,通入硫化氢气体将Cu2+沉淀,操作B除去Fe3+,操作C除去Ca2+。最后加氯化钠电解硫酸镍溶液得到2NiOOH·H2O。
(1)硫酸与氧化镍、氧化铁、氧化钙、氧化铜、氧化钡分别生成硫酸镍、硫酸铁、硫酸钙、硫酸铜和硫酸钡,硫酸钙微溶、硫酸钡难溶,物质X为硫酸钡。Ni2++2H2O Ni(OH)2+2H+,温度升高,促进Ni2+水解,Ni(OH)2含量增大。(2)硫灼烧生成二氧化硫、硫化铜灼烧生成氧化铜和二氧化硫。氧化铜与硫酸生成硫酸铜溶液,结晶后得到胆矾晶体。(3)若溶液中含有Fe2+,调节pH为3.7~7.7时,Fe2+没有完全沉淀。所以加氢氧化钠溶液调节pH时,应先加过氧化氢将Fe2+完全氧化为Fe3+。(4)c(Ca2+)=
Ni(OH)2+2H+,温度升高,促进Ni2+水解,Ni(OH)2含量增大。(2)硫灼烧生成二氧化硫、硫化铜灼烧生成氧化铜和二氧化硫。氧化铜与硫酸生成硫酸铜溶液,结晶后得到胆矾晶体。(3)若溶液中含有Fe2+,调节pH为3.7~7.7时,Fe2+没有完全沉淀。所以加氢氧化钠溶液调节pH时,应先加过氧化氢将Fe2+完全氧化为Fe3+。(4)c(Ca2+)=  =
=  =3×10-6 mol·L-1。(5)Ni2+被ClO-氧化产生2NiOOH·H2O,ClO-被还原为Cl-,根据得失电子相等和电荷守恒、质量守恒配平。
=3×10-6 mol·L-1。(5)Ni2+被ClO-氧化产生2NiOOH·H2O,ClO-被还原为Cl-,根据得失电子相等和电荷守恒、质量守恒配平。
考点: 化工生产流程的分析 盐类的水解 化学实验方案的评价 溶度积计算 离子方程式的书写

 阅读快车系列答案
阅读快车系列答案下列有关化学实验的描述中正确的是
| A.分离乙醇和乙酸要用分液的方法 |
| B.配制一定物质的量浓度的NaCl溶液,如果NaCl固体中含有Na2CO3,所配制溶液中c(Na+)将偏高 |
| C.某无色溶液中加稀硫酸产生无色无味气体,该气体能使澄清石灰水变浑浊,说明该溶液中含CO32- |
D.平衡2NO2 N2O4(无色),减压时,气体颜色变浅,平衡向正反应方向移动 N2O4(无色),减压时,气体颜色变浅,平衡向正反应方向移动 |
用18.4 mol·L-1的浓硫酸配制100 mL浓度为1 mol·L-1的稀硫酸,其操作可分为以下各步:
| A.用量筒量取5.4 mL浓硫酸,缓慢倒入装有约50 mL蒸馏水的烧杯里,并用玻璃棒搅拌 |
| B.用约30 mL蒸馏水,分成三次洗涤烧杯和玻璃棒,将洗涤液都倒入容量瓶中 |
| C.将稀释后的硫酸小心地倒入容量瓶中 |
| D.检查100 mL容量瓶口是否有漏液现象 |
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,至液面最低点与刻度线相切
(1)正确的操作顺序应该是______________________________________________。
(2)进行A步操作的时候,应该选用的是________(填序号)。
①10 mL量筒;②50 mL量筒;③500 mL量筒;④1000 mL量筒
如果对装有浓硫酸的量筒读数如图所示,配制的稀硫酸的浓度将________(填“偏高”、“偏低”或“无影响”)。

(3)进行A步操作后,必须________,才能进行C步操作。
.(16分)化学实验是科学探究的基础。请回答有关实验问题:
(1)下面的四个实验装置有三个都存在明显缺陷,其中完全正确的是 :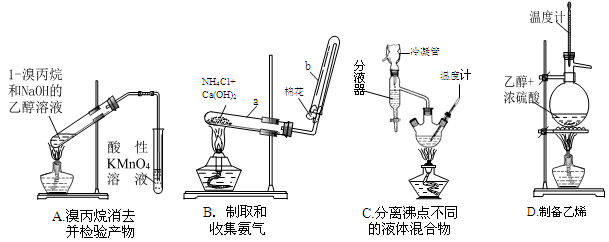
(2)要检验上面B装置氨气已集满的操作是 则试管已集满。
(3)ClO2是一种安全、高效、广谱、强力杀菌剂,其性质如右表:
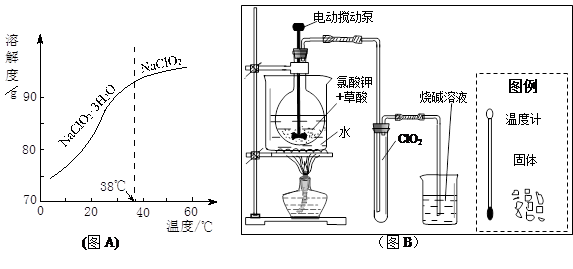
①由下表可以看出:保存液态ClO2的条件是密封、 ;ClO2与碱反应的离子方程式 ;观察下“图A”,要从NaClO2溶液制得不含结晶水的晶体,操作是蒸发结晶,控制条件是 ;应控制析出晶体的温度范围是 。
| 色态 | 溶于碱 | 超过1Kpa、受热或遇光 | |
| 常温气体 | -59-11℃ 红黄色液体 | 生成亚氯酸盐和氯酸盐 | 爆炸 |
②工业用潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用下图B所示装置模拟工业制法制取并收集液态ClO2,请模仿下图B的装置图和图例,在答题卡的相应图中补充完善装置图,并作必要的标注。
(15分)S2Cl2常用于橡胶硫化、有机物氯化的试剂,实验室可利用如下装置来制备S2Cl2。(部分夹持仪器已略去)
已知:①制备的反应方程式为:
②反应涉及的几种物质性质如下:
| 性质 物质 | 熔点 | 沸点 | 着火点 | 其他性质 |
| 单斜硫 | 119.2℃ | 446.6℃ | 363℃ | / |
| 斜方硫 | 112.8℃ | 446.6℃ | 363℃ | / |
| S2Cl2 | -77℃ | 137℃ | / | 遇水强烈分解生成S、SO2和HCl |
(1)A部分仪器装配时,放好铁架台之后,应先固定 (填仪器名称)。整套装置装配完毕后,应先进行 ,再添加试剂,冷凝水进水口是 (填“a”或“b”)。实验完毕,A中不再产生氯气时,可拆除装置,拆除时,最先进行的操作应是 。
(2)S2Cl2分子中各原子均达到8电子稳定结构,写出其电子式 ;用化学方程式表示撤去C装置的后果 ;用直接加热代替水浴加热的后果是 。
(3)单斜硫、斜方硫互称为 ,从熔点、沸点、着火点等信息得到的启示是 。
(4)M溶液可以选择下列试剂中的 (填序号)
①碳酸钠溶液 ②氯化铁溶液 ③亚硫酸钠溶液 ④高锰酸钾溶液