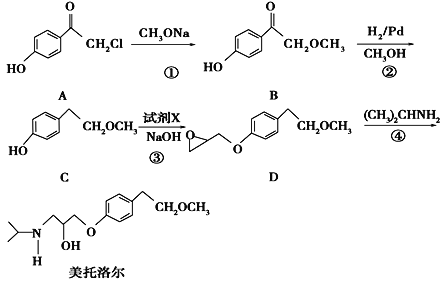
题目内容
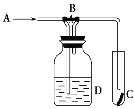
【题目】二茂铁可用作燃料的节能消烟剂、抗爆剂等。实验室制备二茂铁装置示意图如图一
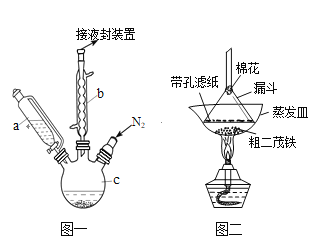
已知:①二茂铁熔点是173℃,在100℃时开始升华;沸点是249℃。
②制备二茂铁的反应原理是:2KOH+FeCl2+2C5H6= Fe(C5H5)2+2KCl+2H2O
实验步骤为:
①在三颈烧瓶中加入25g粉末状的KOH,并从仪器a中加入60mL无水乙醚到烧瓶中,充分搅拌,同时通氮气约10min;
②再从仪器a滴入5.5mL新蒸馏的环戊二烯(C5H6, 密度为0.95g/cm3),搅拌;
③将6.5g无水FeCl2与(CH3)2SO(二甲亚砜,作溶剂)配成的溶液25mL装入仪器a中,慢慢滴入仪器c中,45min滴完,继续搅拌45min;
④再从仪器a加入25mL无水乙醚搅拌;
⑤将c中的液体转入分液漏斗中,依次用盐酸、水各洗涤两次,分液得橙黄色溶液;
⑥蒸发橙黄色溶液,得二茂铁粗产品。
回答下列问题:
(1)仪器b的名称是________________________.
(2)步骤①中通入氮气的目的是____________________________________________________.
(3)仪器c的适宜容积应为(选编号):_________
①100mL ②250mL ③500mL
(4)步骤⑤用盐酸洗涤的目的是__________________________________________________
(5)步骤⑦是二茂铁粗产品的提纯,该过程在图二中进行,其操作名称为_________;该操作中棉花的作用是______________________________________________________.
(6)为了确认得到的是二茂铁,还需要进行的一项简单实验是__________________________;若最终制得纯净的二茂铁4.3g,则该实验的产率为____________(保留三位有效数字)。
【答案】 球形冷凝管 排尽装置中的空气,防止Fe2+被氧化 ② 除去多余的KOH 升华 防止二茂铁挥发进入空气中 测定所得固体的熔点 58.4%
【解析】考查实验方案设计与评价,(1)根据仪器的特点,仪器b为球形冷凝管;(2)Fe2+具有还原性,能被氧气氧化,根据实验目的,通入氮气的目的是排除装置的空气,防止Fe2+被氧化;(3)根据实验,加入到仪器c中液体体积总和为(60+5.5+25+25)mL=115.5mL,因此选用250mL的三颈烧瓶,故②正确;(4)根据制备二茂铁的化学反应方程式,以及所给的KOH、氯化铁、环戊二烯的量,加入KOH应是过量的,因此步骤⑤中加入盐酸的目的是除去多余的KOH;(5)根据信息①,二茂铁在100℃时易升华,因此图二操作名称为升华,棉花的作用是防止升华的二茂铁进入空气中;(6)利用二茂铁的熔点低的特点,检验是否是二茂铁;环戊二烯的质量为5.5×0.95g=5.225g,FeCl2的质量为6.5g,根据反应方程式FeCl2过量,根据环戊二烯进行计算,理论上产生二茂铁的质量为5.225×186/(2×66)g=7.3625g,产率为4.3/7.3625×100%=58.4%。

 出彩同步大试卷系列答案
出彩同步大试卷系列答案【题目】下列“试剂”和“烧杯中的物质”不能完成“实验目的”的是


实验目的 | 试剂 | 烧杯中的物质 | |
A | 醋酸的酸性强于苯酚 | 碳酸氢钠溶液 | ①醋酸 ②苯酚溶液 |
B | 羟基对苯环的活性有影响 | 饱和溴水 | ①苯 ②苯酚溶液 |
C | 甲基对苯环的活性有影响 | 酸性高锰酸钾溶液 | ①苯 ②甲苯 |
D | 乙醇羟基中的氢原子不如水分子中的氢原子活泼 | 金属钠 | ①水 ②乙醇 |
A. A B. B C. C D. D