题目内容
1.下列实验能达到相应目的是( )| A. | 用Ba(OH)2溶液可鉴别(NH4)2SO4、NH4Cl、Na2SO4、NaCl四种溶液 | |
| B. | 用溴水和KSCN溶液判断FeBr3溶液中混有FeBr2 | |
| C. | 用Ba(NO3)2溶液和硝酸检验亚硫酸钠固体是否变质 | |
| D. | 用NaOH溶液提纯混有MgCl2杂质的AlCl3溶液 |
分析 A.(NH4)2SO4、NH4Cl、Na2SO4、NaCl四种溶液分别与Ba(OH)2溶液混合的现象为:白色沉淀和刺激性气体、刺激性气体、白色沉淀、无现象;
B.溴水可氧化亚铁离子,且溴水有颜色;
C.硝酸可氧化亚硫酸钠生成硫酸根离子;
D.反应后氯化镁转化为沉淀,氯化铝转化为偏铝酸钠.
解答 解:A.(NH4)2SO4、NH4Cl、Na2SO4、NaCl四种溶液分别与Ba(OH)2溶液混合的现象为:白色沉淀和刺激性气体、刺激性气体、白色沉淀、无现象,现象不同,可鉴别,故A正确;
B.溴水可氧化亚铁离子,且溴水有颜色,不能利用溴水、KSCN溶液判断FeBr3溶液中混有FeBr2,故B错误;
C.硝酸可氧化亚硫酸钠生成硫酸根离子,应利用盐酸排除亚硫酸根离子干扰,再加含钡离子的试剂检验是否含硫酸根离子确定是否变质,故C错误;
D.反应后氯化镁转化为沉淀,则应加足量NaOH反应后过滤,向滤液中加适量盐酸,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的鉴别、混合物分离提纯、离子检验等,把握物质的性质、发生的反应为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
1.下表是签别浓硫酸和稀硫酸的方法,请将实验现象填入下表:
| 1 | 浓硫酸 | 稀硫酸 | |
| 物理性质 | 加水 | 放出大量的热 | 现象不明显 |
| 观察态 | 无色粘稠状液体 | 无色液体 | |
| 密度 | 浓硫酸的密度大于稀硫酸 | ||
| 化学性质 | 铁片 | 发生钝化 | 铁片逐渐溶解,并产生无色气体 |
| 铜片(加热) | 刺激性气体 | 无现象 | |
| 白纸 | 变黑 | 无现象 | |
| 胆矾 | 变成白色 | 无现象 | |
12.下表为元素周期表的短周期部分.
请参照元素a-h在表中的位置,根据判断出的元素回答问题:
(1)h原子核外有4 种不同伸展方向的电子云,最外层共有7 种不同运动状态的电子.
(2)比较d、e元素常见离子的半径大小(用化学式表示)O2->Na+;b、c 两元素非金属性较强的是(写元素符号)N,写出证明这一结论的一个化学方程式2HNO3+Na2CO3 =2NaNO3+CO2↑+H2O.
(3)d、e元素形成的四原子化合物的电子式为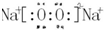 ;b、g元素形成的分子bg2为非极性分子(填写“极性”或“非极性”).
;b、g元素形成的分子bg2为非极性分子(填写“极性”或“非极性”).
上述元素可组成盐R:ca4f(gd4)2,和盐S:ca4agd4,
(4)相同条件下,0.1mol/L 盐R中c(ca4+)小于(填“等于”、“大于”或“小于”)0.1mol/L 盐S中c(ca4+).
(5)向盛有10mL1mol/L盐S溶液的烧杯中滴加1mol/L NaOH溶液至中性,则反应后各离子浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
(6)向盛有10mL 1mol/L盐 R溶液的烧杯中滴加1mol/L NaOH溶液32mL后,继续滴加至35mL写出此时段(32mL-35mL)间发生的离子方程式:NH4++OH-=NH3•H2O.若在10mL 1mol/L 盐R溶液的烧杯中加20mL1.2mol/L Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为0.022mol.
| a | |||||||
| b | c | d | |||||
| e | f | g | h |
(1)h原子核外有4 种不同伸展方向的电子云,最外层共有7 种不同运动状态的电子.
(2)比较d、e元素常见离子的半径大小(用化学式表示)O2->Na+;b、c 两元素非金属性较强的是(写元素符号)N,写出证明这一结论的一个化学方程式2HNO3+Na2CO3 =2NaNO3+CO2↑+H2O.
(3)d、e元素形成的四原子化合物的电子式为
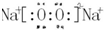 ;b、g元素形成的分子bg2为非极性分子(填写“极性”或“非极性”).
;b、g元素形成的分子bg2为非极性分子(填写“极性”或“非极性”).上述元素可组成盐R:ca4f(gd4)2,和盐S:ca4agd4,
(4)相同条件下,0.1mol/L 盐R中c(ca4+)小于(填“等于”、“大于”或“小于”)0.1mol/L 盐S中c(ca4+).
(5)向盛有10mL1mol/L盐S溶液的烧杯中滴加1mol/L NaOH溶液至中性,则反应后各离子浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
(6)向盛有10mL 1mol/L盐 R溶液的烧杯中滴加1mol/L NaOH溶液32mL后,继续滴加至35mL写出此时段(32mL-35mL)间发生的离子方程式:NH4++OH-=NH3•H2O.若在10mL 1mol/L 盐R溶液的烧杯中加20mL1.2mol/L Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为0.022mol.
9.离子方程式Ca2++2HCO3-+2OH-→CaCO3↓+CO32-+2H2O不能表示( )
| A. | Ca(HCO3)2溶液与NaOH溶液反应 | B. | NaHCO3溶液与澄清石灰水反应 | ||
| C. | KHCO3溶液与澄清石灰水反应 | D. | Ca(HCO3)2溶液与澄清石灰水反应 |
6.下列有关硝酸化学性质的叙述中,正确的是( )
| A. | 敞口放置的浓硝酸浓度变小是因为浓硝酸的吸水性 | |
| B. | 硝酸可与Na2SO3反应制得SO2气体 | |
| C. | 浓硝酸因分解放出的NO2又溶解于硝酸而呈黄色 | |
| D. | 硝酸能与Fe2O3反应,表现氧化性 |
13.下列物质不能通过化合反应或置换反应生成的是( )
| A. | Al2O3 | B. | HF | C. | Fe3O4 | D. | HClO |
11.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 在透明的溶液中:Na+、K+、MnO4-、CO32- | |
| B. | pH>7的溶液中:Fe2+、Cu2+、SO42-、Cl- | |
| C. | 有SO42-存在的溶液中:K+、Mg2+、Ag+、NO3- | |
| D. | 加入金属铝产生H2的溶液中:NH4+、Na+、SO42-、CH3COO- |
 .
.
 ;
;