题目内容
【题目】二氧化碳和乙二醇在氧化锌或锌盐催化下可合成碳酸乙烯酯。
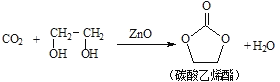
回答下列问题:
(1)锌基态离子的价电子排布图为_______________;在基态18O原子中,核外电子存在_________种空间运动状态。
(2)乙二醇中C、H、O的电负性大小关系是__________ ;碳酸乙烯酯中碳原子的杂化轨道类型有___________;1mol 碳酸乙烯酯中含有的σ键的数目为__________NA。
(3)锌盐水溶液中Zn2+可与H2O之间形成[Zn(H2O)6]2+,配体中的配位原子是_________(填微粒符号),[Zn(H2O)6]2+中所含化学键的类型为__________________________。
(4)阴离子X-与CO2互为等电子体且X-内含共价键和氢键,则X-的化学式为______________。
(5)一种锌金合金晶体的立方体晶胞中,金原子位于顶点,锌原子位于面心,则该合金中金原子与锌原子的个数之比为_________;若该晶体的晶胞棱长为apm(1pm=10-12m),则该合金的密度为_______g·cm-3(用NA表示阿伏加德罗常数的值,列出算式不要求结果)。
【答案】 ![]() 5 O>C>H sp2、sp3 10 O 配位键、共价键 HF2- 1:3 【答题空10】
5 O>C>H sp2、sp3 10 O 配位键、共价键 HF2- 1:3 【答题空10】![]()
【解析】(1)锌为30号元素,锌基态离子的价电子排布式为3d10,电子排布图为![]() ;在基态18O原子核外有8个电子,电子排布式为1s22s22p4,存在1s、2s、2px、2py、2pz,5种空间运动状态,故答案为:
;在基态18O原子核外有8个电子,电子排布式为1s22s22p4,存在1s、2s、2px、2py、2pz,5种空间运动状态,故答案为:![]() ;5;
;5;
(2)元素的非金属性越强,电负性数值越大, C、H、O的电负性大小关系为O>C>H;碳酸乙烯酯(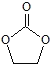 )中有2种碳原子,其中碳氧双键中的碳原子采用sp2杂化,亚甲基中的碳原子采用sp3杂化;1mol碳酸乙烯酯中含有的σ键有:1molC=O,4molC-O,4molC-H,1molC-C,共10molσ键,数目为10NA,故答案为:O>C>H;sp2、sp3;10;
)中有2种碳原子,其中碳氧双键中的碳原子采用sp2杂化,亚甲基中的碳原子采用sp3杂化;1mol碳酸乙烯酯中含有的σ键有:1molC=O,4molC-O,4molC-H,1molC-C,共10molσ键,数目为10NA,故答案为:O>C>H;sp2、sp3;10;
(3)Zn2+含有空轨道,配体H2O含有孤电子对,其中O原子提供孤电子对为配位原子;配离子[Zn(H2O)6]2+中含有配位键、共价键,故答案为:O;配位键、共价键;
(4)阴离子X-与CO2互为等电子体且X-内含共价键和氢键,则X-的化学式为 HF2-,故答案为:HF2-;
(5)在晶胞中,Au原子位于顶点,Zn原子位于面心,该晶胞中Au原子个数=8×![]() =1,Zn原子个数=6×
=1,Zn原子个数=6×![]() =3,所以该合金中Au原子与Zn原子个数之比=1:3,
=3,所以该合金中Au原子与Zn原子个数之比=1:3,
晶胞体积V=(a×10-10cm)3,每个晶胞中锌原子个数是3、Au原子个数是1,则ρ=![]() =
=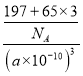 =
=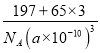 g/cm3,故答案为:1:3;
g/cm3,故答案为:1:3;  。
。