题目内容
某不纯的烧碱样品,含Na2CO3 3.8%(质量百分含量)、H2O 5.8%、NaHCO3 0.004%.取m g样品溶于40mL 2mol?L-1的盐酸后,用 2mol?L-1 NaOH溶液中和剩余的酸,在蒸发后可得干燥的固体的质量为( )
| A、4.68 g |
| B、5.58 g |
| C、2.34 g |
| D、2.34 mg |
考点:化学方程式的有关计算,有关混合物反应的计算
专题:计算题
分析:样品加盐酸反应后剩余固体为NaCl,根据盐酸的物质的量可知NaCl的物质的量,进而计算质量.
解答:
解:样品中Na2CO3、NaHCO3以及NaOH和盐酸反应最终产物都为NaCl,盐酸的物质的量为0.04L×2mol/L=0.08mol,
根据Cl元素守恒可知,生成固体NaCl的物质的量也为0.08mol,
则NaCl的质量为0.08mol×58.5g/mol=4.68g.
故选A.
根据Cl元素守恒可知,生成固体NaCl的物质的量也为0.08mol,
则NaCl的质量为0.08mol×58.5g/mol=4.68g.
故选A.
点评:本题考查混合物的计算,题目难度不大,本题解题关键是判断最终产物的成分

练习册系列答案
相关题目
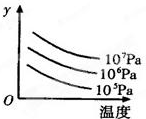 有某可逆反应aA(g)+bB(g)cC(g);△H=Q kJ/mol如图表示外界条件(温度、压强)的变化对上述反应的影响.下列判断正确的是( )
有某可逆反应aA(g)+bB(g)cC(g);△H=Q kJ/mol如图表示外界条件(温度、压强)的变化对上述反应的影响.下列判断正确的是( )| A、a+b<c时,y轴表示平衡混合气中C的质量分数 |
| B、a+b>c时,y轴表示平衡混合气的平均摩尔质量 |
| C、Q>0时,y轴表示达到平衡时B的转化率 |
| D、Q<0时,y轴表示达到平衡时A的浓度 |
 平衡密闭容器中,加入一定量的X和Y,发生如下反应:2X(?)+Y(?)?2Z(?),不同温度时产物Z的生成情况如图所示:a为T1℃时的情况,b为T2℃时的情况,c为T2℃时从时间t3开始向容器中加压的情况.下列叙述正确的是( )
平衡密闭容器中,加入一定量的X和Y,发生如下反应:2X(?)+Y(?)?2Z(?),不同温度时产物Z的生成情况如图所示:a为T1℃时的情况,b为T2℃时的情况,c为T2℃时从时间t3开始向容器中加压的情况.下列叙述正确的是( )| A、X、Y、Z均为气体,正反应放热 |
| B、Y、Z为气体,X为非气体,正反应放热 |
| C、Z为气体,X、Y中至少有一种为非气体,正反应放热 |
| D、t4时刻气体的平均相对分子质量可能小于t3时刻气体的平均相对分子质量 |
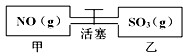 如图,容积相等的甲乙两个容器,通过活塞相连,分别充入NO和SO3且使气体密度相等.打开活塞使气体充分混合,发生反应:SO3(g)+NO(g)?SO2(g)+NO2(g)并达到平衡.反应过程中两容器的温度恒定且相等.则打开活塞前后,容器甲中保持不变的是( )
如图,容积相等的甲乙两个容器,通过活塞相连,分别充入NO和SO3且使气体密度相等.打开活塞使气体充分混合,发生反应:SO3(g)+NO(g)?SO2(g)+NO2(g)并达到平衡.反应过程中两容器的温度恒定且相等.则打开活塞前后,容器甲中保持不变的是( )| A、气体的密度 |
| B、气体分子数 |
| C、气体压强 |
| D、气体平均摩尔质量 |
某温度下,向1L密闭容器中加入3mol A和2mol B发生反应:3A(g)+2B(l)═2C(g)+2D(g).5min后达到平衡,平衡时测得n(D)=1.8mol.下列说法错误的是( )
A、该反应的平衡常数表达式为K=
| ||
| B、反应前后压强不变,反应即达到平衡 | ||
| C、该反应达平衡时,A的转化率为90% | ||
| D、增加B的量,正反应速率增大,平衡正向移动 |
 有机物A常用于食品行业.已知9.0g A在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为O2.
有机物A常用于食品行业.已知9.0g A在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为O2. (一)电解饱和食盐水的阳极产物是
(一)电解饱和食盐水的阳极产物是