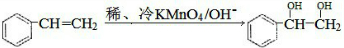题目内容
已知乙炔在燃烧时,有以下两种情况:①2C2H2+5O2→4CO2+2H2O ②2C2H2+3O2→4CO+2H2O,在120℃,1.01×105Pa时,V1L乙炔和O2的混合物在密闭容器中引燃充分反应后,恢复到原来状态,体积变为V2L.将适量的数据填入下表空格中:|
V2与V1的关系 |
反应前V(C2H2)∶V(O2) |
反应后CO2的体积分数(%) |
|
(1) |
V2= |
|
|
(2) |
|
1∶3 |
|
(3) |
V2=V1 |
|
|
(4) |
|
2∶3 |
过量计算能力、天平平衡情况与两托盘中发生化学反应的关系.
解析:
解析:按①反应时,V(C2H2)∶V(O2)≤2∶5 V1∶V2≤![]()
按②反应时,V(C2H2)∶V(O2)≥2∶3 V1∶V2≤![]()
若①②均发生,则2∶5<V(C2H2)∶V(O2)<2∶3
![]()
(1)V2=![]() V1时,
V1时,![]() ,恰好按①反应,
,恰好按①反应,
V(![]() )∶V(
)∶V(![]() )=2∶5 W(
)=2∶5 W(![]() )=
)=![]() ×100%=66.7%
×100%=66.7%
(2)V(C2H2)∶V(O2)=1∶3时O2过量,设V(C2H2)=2VL,则V(O2)=6VL,O2过量VL.V1=8VL,V2=7VL
![]() ,w(
,w(![]() )=
)=![]() ×100%=57.1%
×100%=57.1%
(3)V2=V1时,观察①②,左右两端加合后,体积相等,即V(C2H2)=V(O2)=(2+2)∶(5+3)=1∶2
w(CO2)=![]() ×100%=33.3%
×100%=33.3%
(4)V(C2H2)∶V(O2)=2∶3时,恰好按②式反应,
![]() ,w(
,w(![]() =0.
=0.

(11分)下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ):
|
物质 |
Cl2 |
Br2 |
I2 |
HCl |
HBr |
HI |
H2 |
|
能量(kJ) |
243 |
193 |
151 |
431 |
366 |
298 |
436 |
根据上述数据问题。
(1)下列物质本身具有的能量最低的是 _____(填序号)A.H2 B.Cl2 C.Br2 D.I2
化合物HCl、HBr、HI中______受热时最稳定。
(2)1molH2在2mol Cl2中燃烧,放出热量________ kJ 。一定条件下,1mol H2分别与足量Cl 2、Br2、I2反应,放出热量由多到少的顺序是________ (填序号)A Cl 2<Br2<I2 B Cl 2>Br2>I2
(3)下列有关化学键及键参数的说法中正确的是 (填序号)
① 原子或分子间的相互作用叫化学键
② 氯分子中两个氯原子间的距离是键长
③ 键长的大小与成键原子的半径和成键数目有关
④ 键角是描述分子立体结构的重要参数
(4)下列事实不能用键能的大小来解释的是 (填序号)
A.乙炔比氮气均含三键但是前者比后者容易发生加成反应
B.N2、O2、F2跟氢气的反应能力依次增强
C.硝酸是挥发性酸,而硫酸、磷酸是难不挥发性酸
(5)氰气[(CN)2]无色、剧毒、有苦杏仁味,和卤素单质性质相似。
①写出(CN)2与苛性钠溶液反应的离子方程式______________________;
②已知氰分子中键与键之间的夹角为180.,并有对称性, 则结构式为_______
③氰分子中碳原子为_______杂化;一个氰分子中包含_______个σ键,____个π键。

 .请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式
.请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式