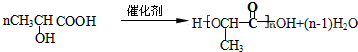
题目内容
1.常温下取金属钠、铝、铁各1克,加入1mol/L的硫酸V升,要使铝、铁反应后放出等量的氢气,且比钠反应生成的氢气少,V的大小范围是( )| A. | V≥$\frac{1}{18}$ | B. | V≤$\frac{1}{23}$ | C. | V<$\frac{1}{18}$ | D. | V≤$\frac{1}{56}$ |
分析 1g钠、铝、铁的物质的量分别为$\frac{1}{23}$mol、$\frac{1}{27}$mol、$\frac{1}{56}$mol,由与硫酸的反应关系2Na~H2SO4、2Al~3H2SO4、Fe~H2SO4,可知,如完全反应,各需硫酸的物质的量为$\frac{1}{46}$mol、$\frac{1}{18}$mol、$\frac{1}{56}$mol,要使铝、铁反应后放出等量的氢气,且比钠反应生成的氢气少,则说明与铁、铝反应时硫酸不足,而过量的钠可与水反应,以此解答该题.
解答 解:要使铝、铁反应后放出等量的氢气,且比钠反应生成的氢气少,则说明与铁、铝反应时硫酸不足,而过量的钠可与水反应,
1g钠、铝、铁的物质的量分别为$\frac{1}{23}$mol、$\frac{1}{27}$mol、$\frac{1}{56}$mol,由与硫酸的反应关系2Na~H2SO4、2Al~3H2SO4、Fe~H2SO4,可知,如完全反应,各需硫酸的物质的量为$\frac{1}{46}$mol、$\frac{1}{18}$mol、$\frac{1}{56}$mol,
则可知当硫酸的体积V≤$\frac{1}{56}$时,铁、铝过量,硫酸完全反应,生成的氢气的物质的量≤$\frac{1}{56}$mol,
但过量的钠可与水反应生成氢气,1g钠完全反应放出氢气的物质的量为$\frac{1}{46}$mol,
故选D.
点评 本题考查过量问题的计算,侧重于学生的分析能力和计算能力的考查,题目难度中等,根据要使铝、铁反应后放出等量的氢气,且比钠反应生成的氢气少,则说明与铁、铝反应时硫酸不足是解题关键,注意掌握判断反应物过量的计算题的解题方法与技巧.

练习册系列答案
相关题目
11.各可逆反应达平衡后,改变反应条件,其变化趋势正确的是( )
| A. | 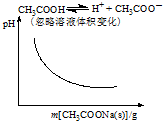 | B. | 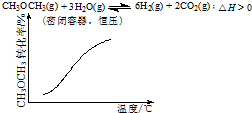 | ||
| C. |  | D. | 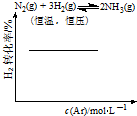 |
12.将2mol A和1mol B充入到绝热恒容密闭容器中,发生反应2A(g)+B(g)═3C(g)+D(s),达到平衡时测得容器内压强增大.若该反应在恒温恒容的密闭容器中进行,下列有关说法正确的是( )
| A. | 平衡前,随着反应的进行,容器内压强始终不变 | |
| B. | 平衡时,分离出少量D,A的转化率提高 | |
| C. | 平衡时,升高温度,容器内混合气体的密度减小 | |
| D. | 平衡时,充入C,该反应平衡常数减小 |
6.设nA为阿伏加德罗常数的数值.下列说法正确的是( )
| A. | 常温常压下,1mol21H2含有nA个质子 | |
| B. | 1molCu与足量FeCl3溶液充分反应转移了2nA个电子 | |
| C. | 含49gH2SO4的硫酸溶液中含有nA个氢原子 | |
| D. | 标准状况下,22.4L甲醇含有nA个分子 |
6.已知反应A+B=C+D的能量变化如图所示,下列说法正确的是( )
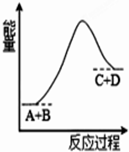

| A. | 该反应为释放能量 | |
| B. | 该反应为吸收能量 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 该反应只有在加热条件下才能进行 |
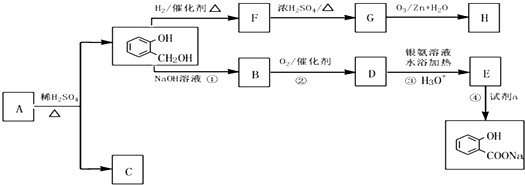
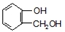 到F反应是否进行完全,可用FeCl3溶液检验
到F反应是否进行完全,可用FeCl3溶液检验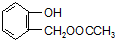 ,由F到G的反应类型为消去反应.
,由F到G的反应类型为消去反应.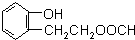 和
和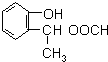 (不考虑立体异构).
(不考虑立体异构). .
.
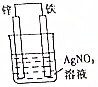 原电池原理的发现是储能和功能技术的巨大进步,是化学对人类的一项重大贡献.
原电池原理的发现是储能和功能技术的巨大进步,是化学对人类的一项重大贡献.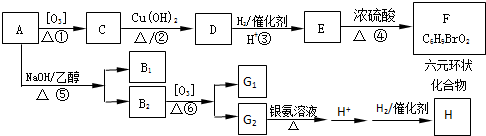
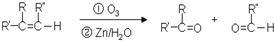
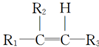 $\stackrel{[O_{3}]}{→}$
$\stackrel{[O_{3}]}{→}$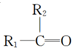 +
+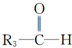
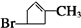

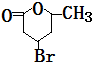 +H2O
+H2O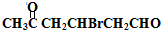 +2Cu(OH)2+NaOH$\stackrel{△}{→}$
+2Cu(OH)2+NaOH$\stackrel{△}{→}$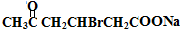 +Cu2O↓+3H2O
+Cu2O↓+3H2O