题目内容
试比较含氧酸的酸性强弱(填“>”、“<”或“=”):HClO3 HClO4.
考点:非金属在元素周期表中的位置及其性质递变的规律
专题:元素周期律与元素周期表专题
分析:判断含氧酸(含有氧元素的酸)酸性强弱的一条经验规律是:含氧酸分子的结构中含非羟基(羟基为-OH)氧原子数越多,该含氧酸的酸性越强.
解答:
解:含氧酸分子的结构中含非羟基(羟基为-OH)氧原子数越多,该含氧酸的酸性越强,所以含氧酸的通式可写成(HO)mROn,如果成酸元素R相同,则n值越大,酸性越强,则酸性:HClO3<HClO4;
故答案为:<.
故答案为:<.
点评:本题考查了酸性强弱的比较,题目难度不大,注意判断含氧酸酸性的方法:含氧酸分子的结构中含非羟基(羟基为-OH)氧原子数越多,该含氧酸的酸性越强.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
下列各组中的离子,能大量共存的是( )
| A、K+,H+,Cl-,SO42- |
| B、K+、Fe2+、NO3-、H+ |
| C、HCO3-、Na+、H+、NO3- |
| D、Na+、K+、CO32-、NO3- |
用R代表短周期元素,R原子最外层的p能级上的未成对电子只有2个.下列关于R的描述中正确的是( )
| A、R的氧化物都能溶于水 |
| B、R都是非金属元素 |
| C、R的氧化物都能与NaOH反应 |
| D、R的最高价氧化物对应的水化物都是H2RO3 |
下列叙述中,不正确的是( )
①原子晶体中只含有极性键
②金属在常温时都以晶体形式存在
③离子晶体一定含离子键,也可能有共价键
④分子晶体中一定有分子间作用力,有的还可能有氢键.
①原子晶体中只含有极性键
②金属在常温时都以晶体形式存在
③离子晶体一定含离子键,也可能有共价键
④分子晶体中一定有分子间作用力,有的还可能有氢键.
| A、①④ | B、②③ | C、①② | D、①③ |
下列物质属于共价化合物的是( )
| A、KOH |
| B、MgO |
| C、H2O |
| D、N2 |
化学反应前后可能发生变化的是( )
| A、物质的总质量 | B、元素种类 |
| C、原子数目 | D、分子数目 |
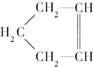 可简写为
可简写为 降冰片烯的分子结构可表示为:
降冰片烯的分子结构可表示为: