题目内容
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等.
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式:________.
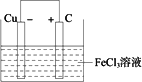
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式.
正极反应________,负极反应________.
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤________.

(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显.请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀.
有关反应的化学方程式:____________;
劣质不锈钢腐蚀的实验现象:________.
解析:
|
答案:(1)2Fe3++Cu (2)装置图
正极反应:Fe3++e- 负极反应:Cu (3)①通入足量氯气将Fe2+氧化成Fe3+;②加入CuO调节溶液的pH至3.2-4.7;③过滤(除去Fe(OH)3) (4)CuO+H2SO4 不锈钢表面有紫红色物质生成 解析:本题考查了铁及其化合物、原电池和沉淀溶解的知识,也考查了分析问题的能力.问题(1):Fe3+具有强氧化性,可以把一些金属单质如铁、铜等氧化成相应的离子,Fe3+腐蚀铜制电路板利用的就是这个原理,反应的离子方程式是:2Fe3++Cu 问题(2):由反应2Fe3++Cu 发生的电极反应为:正极反应:Fe3++e- 负极反应:Cu 问题(3):除杂时,要把杂质全部除去,又不能引入新的杂质.根据题给信息可知:Fe3+的氢氧化物从开始沉淀到沉淀完全的pH范围是1.9-3.2,Fe2+的氢氧化物从开始沉淀到沉淀完全的pH范围是7.0-9.0,Cu2+的氢氧化物从开始沉淀到沉淀完全的pH范围是4.7-6.7.当pH为3.2时Fe3+完全沉淀,此时Cu2+不会沉淀,要使Fe2+完全沉淀需要使溶液的pH为9.0,此时Cu2+已经完全沉淀.因此,若要除去CuCl2溶液中的Fe3+、Fe2+,需要将Fe2+全部转化为Fe3+,采取的措施是向溶液中通入过量的氯气;为了不引入其他杂质,可以向溶液中加入CuO调节溶液的pH范围在3.2-4.7之间,此时Fe3+完全沉淀;最后过滤,即可得到纯净的氯化铜溶液.实验步骤见答案. 问题(4):不锈钢在某些盐溶液中比在酸溶液中腐蚀明显,说明这些盐溶液中的金属阳离子的氧化性比H+的氧化性强,即这些金属在金属活动性顺序表中位于氢的后面.要设计实验验证劣质不锈钢易被腐蚀,需要有容易与铁反应的盐,根据提供的药品可知这种盐是硫酸铜,制取硫酸铜的最佳方案是用氧化铜与稀硫酸反应制取,这种方法比浓硫酸与铜反应节省硫酸,并且不产生污染环境的SO2.实验步骤是:1.用适量水将浓硫酸稀释制取稀硫酸,2.用氧化铜与稀硫酸反应制取硫酸铜,3.将不锈钢加入硫酸铜溶液中观察现象.有关化学方程式和实验现象见答案. |

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案