题目内容
8.下列物质中不能由单质直接化合生成的是( )①CuS ②FeS ③SO3 ④Fe2O3 ⑤FeCl2⑥Hg2S.
| A. | ①②③⑤ | B. | ①③⑤⑥ | C. | ①③④⑤⑥ | D. | .全部 |
分析 ①硫和变价金属反应时将变价金属氧化为较低价态,铜和硫反应生成硫化亚铜;
②铁和硫加热反应生成硫化亚铁;
③硫单质和氧气反应只能生成二氧化硫;
④金属铁在氧气中燃烧生成四氧化三铁;
⑤铁和氯气反应只能生成氯化铁;
⑥Hg和S反应可以得到硫化汞.
解答 解:①硫和变价金属反应时将变价金属氧化为较低价态,铜和硫反应生成硫化亚铜,2Cu+S$\frac{\underline{\;\;△\;\;}}{\;}$Cu2S,故①正确;
②铁和硫加热反应生成硫化亚铁,Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS,故②错误;
③无论S是否过量,S在氧气中燃烧都生成SO2,所以能由单质直接化合生成,S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,故③正确;
④金属铁在氧气中燃烧生成四氧化三铁,3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4,故④正确;
⑤铁和氯气反应生成氯化铁,2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,故⑤正确;
⑥Hg和S反应可以得到硫化汞HgS,即Hg+S=HgS,故⑥正确;
①③④⑤⑥不能由单质直接化合生成,
故选C.
点评 本题考查物质之间的反应,明确物质的性质是解本题关键,掌握物质性质和反应条件是解题关键,题目难度不大.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
18.进行化学实验时应强化安全意识.下列做法正确的是( )
| A. | 金属钠着火时使用泡沫灭火器灭火 | |
| B. | 制备乙烯时向乙醇和浓硫酸的混合液中加入碎瓷片 | |
| C. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| D. | 用试管加热碳酸氢钠固体时使试管口竖直向上 |
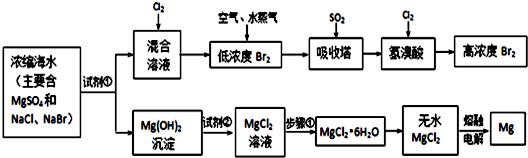
19.从海带中提取碘,可经过如图实验步骤完成,下列有关说法正确的是( )

| A. | 在灼烧过程中使用的仪器有酒精灯、三脚架、泥三角、蒸发皿、玻璃棒 | |
| B. | 在上述氧化过程中发生的离子方程式为:2I-+H2O2═I2+2OH- | |
| C. | 在分液时,待下层液体完全流出后,关闭旋塞,上层液体从上口倒出 | |
| D. | 在提取碘单质时,用酒精作萃取剂 |
3.下列各组物质中,将前者加入后者时,无论前者是否过量,都能用同一个化学方程式表示的是( )
| A. | 稀盐酸,Na2CO3溶液 | B. | 稀H2SO4溶液,NaAlO2溶液 | ||
| C. | Cl2,NaBr溶液 | D. | CO2,澄清石灰水 |
20.已知反应:①101kPa时,2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1
②稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1
④H2O(g)═H2O(l)△H=-44.0kJ•mol-1
下列结论正确的是( )
②稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1
④H2O(g)═H2O(l)△H=-44.0kJ•mol-1
下列结论正确的是( )
| A. | 碳的燃烧热大于110.5 kJ•mol-1 | |
| B. | 浓硫酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 | |
| C. | 氢气的燃烧热为241.8 kJ•mol-1 | |
| D. | 2H2(g)+O2(g)=2H2O(l) 的反应热为△H=+571.6 kJ•mol-1 |
18.A、B、C、D四种元素在周期表中分别处于元素X的四周(如图),已知X元素最高价氧化物的化学式为X2O5,且五种元素中有一种元素的原子半径是它们所处的同族中最小的.试确定:
(1)各元素的符号:A:Si,B:N,C:S,X:P.
(2)画出C元素的简单阴离子的结构示意图: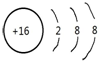
(3)C、D、X最高价氧化物对应水化物酸性由强到弱的顺序:C>X>D(用C、D、X表示).
(4)把A、B、X气态氢化物按照稳定性由强到弱的顺序排列:SiH4<PH3<NH3(用化学式表示).
附加题:A、B、C、D是原子序数小于20的四种元素,已知A元素+1价的阳离子与B、D的阴离子具有相同的电子层结构,B元素最高正价与负价的绝对值之差等于6.1mol C单质与足量的稀硫酸反应可生成1.5mol H2,反应后C元素原子形成的离子和氖原子的电子层结构相同.D元素原子的最外层电子数是C元素原子的最外层电子数的2倍.试回答:
(1)A、B、C、D四种元素依次是钾、氯、铝、硫(写出元素名称).
(2)写出A与C、B与D最高价氧化物的水化物的化学式(按酸性或碱性由强至弱的顺序)碱性:KOH>Al(OH)3,酸性:HClO4>H2SO4.
(3)写出A、C两元素最高价氧化物的水化物间反应的化学方程式Al(OH)3+OH-=AlO2-+2H2O.
| B | ||
| A | X | C |
| D |
(2)画出C元素的简单阴离子的结构示意图:
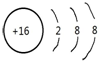
(3)C、D、X最高价氧化物对应水化物酸性由强到弱的顺序:C>X>D(用C、D、X表示).
(4)把A、B、X气态氢化物按照稳定性由强到弱的顺序排列:SiH4<PH3<NH3(用化学式表示).
附加题:A、B、C、D是原子序数小于20的四种元素,已知A元素+1价的阳离子与B、D的阴离子具有相同的电子层结构,B元素最高正价与负价的绝对值之差等于6.1mol C单质与足量的稀硫酸反应可生成1.5mol H2,反应后C元素原子形成的离子和氖原子的电子层结构相同.D元素原子的最外层电子数是C元素原子的最外层电子数的2倍.试回答:
(1)A、B、C、D四种元素依次是钾、氯、铝、硫(写出元素名称).
(2)写出A与C、B与D最高价氧化物的水化物的化学式(按酸性或碱性由强至弱的顺序)碱性:KOH>Al(OH)3,酸性:HClO4>H2SO4.
(3)写出A、C两元素最高价氧化物的水化物间反应的化学方程式Al(OH)3+OH-=AlO2-+2H2O.


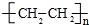 ,该反应属于加聚反应;
,该反应属于加聚反应;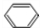 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$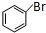 +HBr.
+HBr.