题目内容
17.下表中的实验内容不能达到实验目的或不能得出相应实验结论的是( )| 编号 | 实验内容 | 实验目的或实验结论 |
| ① | 利用一束强光照射矾溶液,产生光亮的“通路”. | 说明明矾一定发生了水解 |
| ② | 向bmL0.1mol/LAgNO3溶液中滴加1mL0.1mol/LNaCl溶液,有白色沉淀生成,再向其中滴加1mL0.1mol/LKI溶液,有黄色沉淀生成. | 验证AgCl的溶解度比AgI大 |
| ③ | 向KI溶液中滴入CuSO4溶液,有白色沉淀生成,但无气体产生,再加入四氧化碳振荡,四氧化碳层呈紫色 | 说明白色沉淀可能为CuI |
| ④ | 室温下,分别向2支试管中加入相同体积,相同浓度的Na2S2O3溶液,再分别加入等体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
| ⑤ | 将铁粉投入到盛有稀HNO3的试管中,充分反应后滴入几滴KSCN溶液无明显现象 | 说明HNO3将Fe氧化成Fe2+ |
| A. | ①③ | B. | ③⑤ | C. | ③④ | D. | ②⑤ |
分析 ①产生光亮的“通路”,可知具有丁达尔现象,为胶体特有的性质;
②b>1时,硝酸银过量,发生沉淀的生成;
③发生氧化还原反应生成CuI和碘;
④只有硫酸浓度一个变量;
⑤充分反应后滴入几滴KSCN溶液无明显现象,可知Fe与硝酸反应时Fe过量.
解答 解:①产生光亮的“通路”,可知具有丁达尔现象,为胶体特有的性质,所以明矾一定发生了水解生成胶体,故正确;
②b>1时,硝酸银过量,发生沉淀的生成,不能发生沉淀的转化,则不能比较AgCl、AgI的溶解度,故错误;
③发生氧化还原反应生成CuI和碘,有白色沉淀生成,白色沉淀为CuI,再加入四氯化碳,振荡,四氧化碳层呈紫色,故正确;
④只有硫酸浓度一个变量,可研究稀硫酸浓度对反应速率的影响,故正确;
⑤充分反应后滴入几滴KSCN溶液无明显现象,可知Fe与硝酸反应时Fe过量,应为Fe与硝酸反应生成硝酸铁,Fe与硝酸铁反应生成硝酸亚铁,故错误;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及胶体的性质、沉淀转化和生成、氧化还原反应、反应速率等,把握反应原理及实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.下列实验方案中,能测定Na2CO3和NaCl混合物中NaCl质量分数的是( )
| A. | 取a克混合物与足量浓盐酸充分反应,通过排饱和NaHCO3溶液测得生成气体b升(标准状况) | |
| B. | 取a克混合物与足量硝酸银溶液充分反应,过滤、洗涤、烘干,得b克固体 | |
| C. | 取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克 | |
| D. | 取a克混合物与足量Ba(OH)2溶液充分反应,过滤,称量得b克固体 |
12.下列实验操作或结论正确的是( )
| A. | 配制一定物质的量浓度的溶液时,将量取液态物质的量筒用水洗涤,洗涤液倒入容量瓶 | |
| B. | 用加热法可以分离KMnO4和碘单质的混合物 | |
| C. | 经氯气消毒的自来水,若用于配制Na2CO3溶液和FeSO4溶液均会使所配溶液变质 | |
| D. | 将金属钠在研钵中研成粉末,使钠与水反应的实验更安全 |
2.下列关于2760Co原子的叙述不正确的是( )
| A. | 中子数为33 | B. | 质量数为60 | C. | 质子数为60 | D. | 电子数为27 |
7.下列实验方案或操作正确的( )
| A. | 用饱和Na2CO3 溶液除去CO2中含有的HCl | |
| B. | 往白色ZnS沉淀中滴加CuSO4溶液,沉淀变黑,证明:Ksp(CuS)<Ksp(ZnS) | |
| C. | 进行酸碱中和滴定时,眼睛要注视滴管液面的变化 | |
| D. | 中和热测定实验时,应将NaOH溶液缓慢倒入盐酸中 |

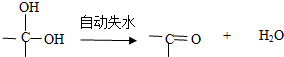
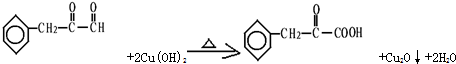
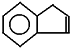 ,茚有一种同分异构体A,A分子中含有一个苯环且只有一个侧链,A有如下转化关系:
,茚有一种同分异构体A,A分子中含有一个苯环且只有一个侧链,A有如下转化关系: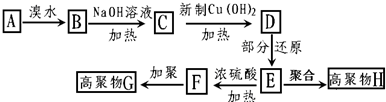
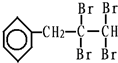 、C的结构简式:
、C的结构简式: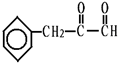

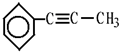
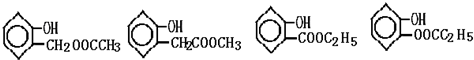 (任写一个)
(任写一个)