题目内容
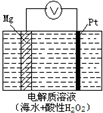
 镁-过氧化氢燃料电池具有能量高、安全方便等优点,其总反应为Mg+H2O2+H2SO4?MgSO4+2H2O.结构示意图如图所示.下列关于该电池的叙述正确的是( )
镁-过氧化氢燃料电池具有能量高、安全方便等优点,其总反应为Mg+H2O2+H2SO4?MgSO4+2H2O.结构示意图如图所示.下列关于该电池的叙述正确的是( )| A、电池内部可以使用MnO2作填料 | B、电流工作时,H+向Mg电极移动 | C、电池工作时,正极的电极反应式为Mg-2e-?Mg2+ | D、电池工作时,电解质溶液的pH将不断变大 |
分析:A、加入MnO2作填料,能使双氧水加速分解;
B、电流工作时,H+向正极移动;
C、负极是金属镁发生失电子的氧化反应,即Mg-2e-═Mg2+;
D、根据总反应:Mg+H2O2+H2SO4═MgSO4+2H2O,电池工作时,消耗硫酸.
B、电流工作时,H+向正极移动;
C、负极是金属镁发生失电子的氧化反应,即Mg-2e-═Mg2+;
D、根据总反应:Mg+H2O2+H2SO4═MgSO4+2H2O,电池工作时,消耗硫酸.
解答:解:A、根据总反应:Mg+H2O2+H2SO4═MgSO4+2H2O可知电池中有双氧水,加入MnO2作填料,能使双氧水加速分解,所以不能用MnO2作填料,故A错误;
B、电流工作时,H+向正极移动,Mg失电子为负极,故B错误;
C、根据总反应:Mg+H2O2+H2SO4═MgSO4+2H2O,则负极是金属镁发生失电子的氧化反应,即Mg-2e-═Mg2+,故C错误;
D、根据总反应:Mg+H2O2+H2SO4═MgSO4+2H2O,电池工作时,消耗硫酸,溶液中氢离子浓度减小,所以电解质溶液的pH将不断变大,故D正确.
故选:D.
B、电流工作时,H+向正极移动,Mg失电子为负极,故B错误;
C、根据总反应:Mg+H2O2+H2SO4═MgSO4+2H2O,则负极是金属镁发生失电子的氧化反应,即Mg-2e-═Mg2+,故C错误;
D、根据总反应:Mg+H2O2+H2SO4═MgSO4+2H2O,电池工作时,消耗硫酸,溶液中氢离子浓度减小,所以电解质溶液的pH将不断变大,故D正确.
故选:D.
点评:本题考查原电池的工作原理,题目难度不大,本题注意把握电极反应式的书写,正确判断离子的定向移动.

练习册系列答案
相关题目
镁-过氧化氢燃料电池具有比能量高、安全方便等优点,其结构示意图如图所示.该电池的总反应式为:Mg+H2O2+H2SO4=MgSO4+2H2O关于该电池的叙述正确的是( )
| A、该电池可以在高温下正常工作 | B、电池工作时,H+向正极移动 | C、电池工作时,正极周围溶液的pH将不断变小 | D、正极反应方程式为:H2O2+2H++2e-=2H2O |
 美国海军海底战事中心与麻省理工大学共同研制成功了用于潜航器的镁-过氧化氢燃料电池系统.其工作原理如图所示.以下说法中错误的是( )
美国海军海底战事中心与麻省理工大学共同研制成功了用于潜航器的镁-过氧化氢燃料电池系统.其工作原理如图所示.以下说法中错误的是( ) 镁-过氧化氢燃料电池具有比能量高、安全方便等优点,其结构示意图如图所示. 关于该电池的叙述正确的是( )
镁-过氧化氢燃料电池具有比能量高、安全方便等优点,其结构示意图如图所示. 关于该电池的叙述正确的是( )