题目内容
16.下列溶液中有关物质的量浓度关系正确的是( )| A. | 0.1mol•L-1的Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) | |
| B. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) | |
| C. | 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) | |
| D. | 0.1mol•L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
分析 A.任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断;
B.CH3COONa和Na2CO3是盐,pH相同的这两种钠盐溶液,弱酸根离子水解程度越大其钠盐浓度越小,NaOH是强碱,相同pH时其浓度最小;
C.任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断;
D.NaHA溶液pH=4,说明HA-的电离程度大于水解程度,但其电离程度和水解程度都较小,且水也电离生成H+.
解答 解:A.任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒得2c(CO32-)+c(HCO3- )+c(OH-)=c(Na+ )+c(H+ ),根据物料守恒得2[c(CO32-)+c(HCO3- )+c(H2CO3)]=c(Na+ ),所以得c(OH-)=c(H+)+c(HCO3- )+2c(H2CO3),故A错误;
B.CH3COONa和Na2CO3是盐,pH相同的这两种钠盐溶液,弱酸根离子水解程度越大其钠盐浓度越小,水解程度CO32->CH3COO-,所以相同pH的CH3COONa和Na2CO3,浓度c(CH3COONa)>c(Na2CO3),
NaOH是强碱,相同pH时其浓度最小,所以pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa),故B错误;
C.电荷守恒为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒为c(CH3COO-)+c(CH3COOH)=2c(Na+),所以c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH),故C正确;
D.NaHA溶液pH=4,溶液呈酸性,说明HA-的电离程度大于水解程度,所以c(A2-)>c(H2A),但其电离程度和水解程度都较小,且水也电离生成H+,所以这离子微粒浓度大小顺序是c(HA-)>c(H+)>c(A2-)>c(H2A),故D错误;
故选C.
点评 本题考查离子浓度大小比较,为高频考点,把握盐类水解及弱电解质电离特点是解本题关键,会根据溶液酸碱性判断弱酸酸式盐弱酸氢根离子电离和水解程度相对大小,易错选项是B,题目难度中等.

| A | B | C | D | |
| 污染物 | 二氧化硫 | 甲醛 | 氮氧化物 | 悬浮颗粒物 |
| 来源 | 雷电时空气中产生 | 人造家具、用具 | 燃煤、汽车尾气 | 燃煤、施工 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 向某溶液中滴加AgNO3溶液后产生白色沉淀,说明原溶液中含有Cl- | |
| B. | 向某溶液中滴加BaCl2溶液后产生白色沉淀,说明原溶液中含有SO42- | |
| C. | 向某溶液中滴加NaOH溶液并加热,产生气体能使红色石蕊试纸变蓝,说明原溶液中含有NH4+ | |
| D. | 向某溶液中滴加稀硫酸后生成无色无味气体,说明原溶液中含有CO32- |
| A. | 质子数为8的氧原子: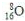 | |
| B. | 漂白粉的有效成分:NaClO | |
| C. | Mg2+结构示意图: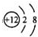 | |
| D. | 钠在氧气中燃烧的化学方程式:4Na+O2 $\frac{\underline{\;点燃\;}}{\;}$2Na2O |
| A. | 仅用AgNO3溶液便可鉴别亚硝酸钠和食盐 | |
| B. | 重结晶时,溶液冷却速度越慢得到的晶体颗粒越大 | |
| C. | 乙酸与乙醇的混合液可用分液漏斗进行分离 | |
| D. | 教材中用纸层析法分离Fe3+和Cu2+实验,滤纸上吸附的丙酮作为固定相,水作为流动相 |
| A. | Fe元素的化合价升高 | B. | Al被还原 | ||
| C. | Fe2O3发生还原反应 | D. | Al是还原剂 |
| A. | 温室效应--二氧化硫 | B. | 光化学污染--二氧化氮 | ||
| C. | 酸雨--二氧化硫 | D. | 臭氧层破坏--氟氯烃 |
| A. | NaHCO3溶液中HCO3-水解:HCO3-+H2O?H2CO3+OH- | |
| B. | AlCl3溶液中Al3+水解:Al3++3H2O═Al(OH)3↓+3H+ | |
| C. | NaHS溶液中HS-水解:HS-+H2O?H3O++S2- | |
| D. | 碳酸溶液中H2CO3的电离:H2CO3?2H++CO32- |
 ;
;