题目内容
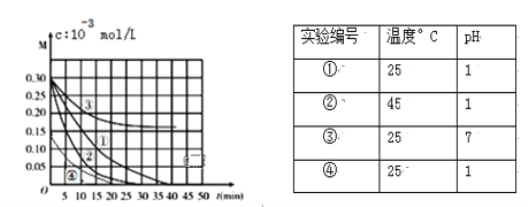
【题目】常温下,用0.100molL-1NaOH溶液分别滴定20.00mL浓度均0.100molL-1CH3COOH溶液和HCN溶液,所得滴定曲线如图。下列说法不正确的是( )
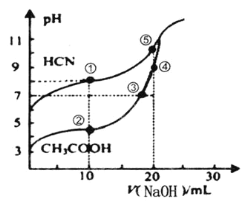
A.点①和点②所示溶液中:c(CH3COO-)>c(CN-)
B.点③时:c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
C.点③和点④所示溶液中水的电离程度:③<④
D.点④溶液中阴离子总数小于点⑤
【答案】D
【解析】
根据图像初始pH可知,浓度为0.100molL-1CH3COOH溶液和HCN溶液均为弱酸,且HCN的酸性比弱酸小,电离程度小;酸或碱抑制水的电离,盐促进水的电离,根据三大守恒关系回答问题。
A. 点①的溶液中存在电荷守恒为c(OH-)+c(CN-)=c(Na+)+c(H+),而且c(OH-)>c(H+),点②所示溶液中的电荷守恒为c(OH-)+c(CH3COO-)=c(Na+)+c(H+),而且c(OH-)<c(H+),二者中钠离子浓度相同,所以c(CH3COO-)>c(CN-),A正确;
B. 点③电荷守恒关系,c(OH-)+c(CH3COO-)=c(Na+)+c(H+),根据pH=7可知,c(Na+)=c(CH3COO-)>c(H+)=c(OH-),B正确;
C. 点③溶液中含有醋酸钠和醋酸,点④溶液中只含有醋酸钠,酸抑制水的电离,盐促进水的电离,所示溶液中水的电离程度:③<④,C正确;
D. 点④溶液为醋酸钠,点⑤溶液为NaCN,故电荷守恒可知,阴离子浓度总数=c(H+)+c(Na+),由图可知,点④溶液氢离子浓度大,故点④溶液中阴离子总数大于点⑤,D错误。
答案为D。

【题目】已知:CH3CH2CH2CH2OH![]() CH3CH2CH2CHO;利用如图装置用正丁醇合成正丁醛相关数据如表:
CH3CH2CH2CHO;利用如图装置用正丁醇合成正丁醛相关数据如表:
物质 | 沸点/℃ | 密度 / gcm-3 | 水中溶解性 |
|
正丁醇 | 117.2 | 0.8109 | 微溶 | |
正丁醛 | 75.7 | 0.8017 | 微溶 |
下列说法中,不正确的是
A.为防止产物进一步氧化,应将酸化的Na2Cr2O7溶液逐滴加入正丁醇中
B.当温度计1示数为90~95℃,温度计2示数在76℃左右时,收集产物
C.反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出
D.向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇