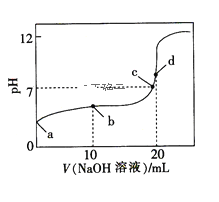
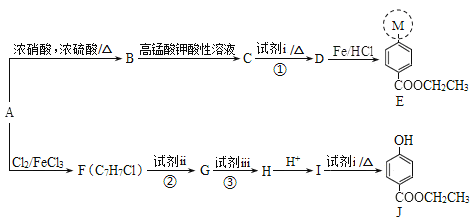
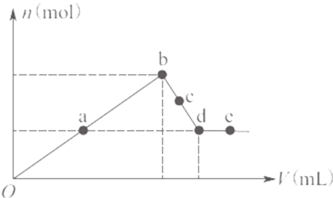
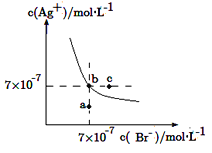
题目内容
【题目】![]() △H =akJ/mol ;
△H =akJ/mol ;![]() △H =bkJ/mol。P4具有正四面体结构,PCl5 中 P-Cl 键的键能为cKJ/mol、,PCl3 中 P-Cl 键的键能为1.2cKJ/mol。下列叙述正确的是( )
△H =bkJ/mol。P4具有正四面体结构,PCl5 中 P-Cl 键的键能为cKJ/mol、,PCl3 中 P-Cl 键的键能为1.2cKJ/mol。下列叙述正确的是( )
A.P-P 键的键能大于P-Cl 键的键能
B.可求 ![]() 的反应热 △H
的反应热 △H
C.P-P 键的键能为 ![]()
D.Cl-Cl 键的键能 ![]()
【答案】D
【解析】
A. 由于P的原子半径大于Cl,则P-P键的键长大于P-Cl键的键长,即P-P 键的键能小于P-Cl 键的键能,A错误;
B. 利用盖斯定律,可求出![]()
![]()
![]() ,但是不知道
,但是不知道![]() 的反应热,故无法求出
的反应热,故无法求出![]() 的反应热 △H,B错误;
的反应热 △H,B错误;
C. P4具有正四面体结构,则1molP单质有6molP-P键,![]() ,所以
,所以![]() ,C错误;
,C错误;
D. ![]()
![]()
![]() ,
,![]() ,所以
,所以![]() ,D正确;
,D正确;
故答案选D。

练习册系列答案
相关题目
【题目】4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性.![]() 称为拟卤素,性质与卤素相似.下列说法不正确的是( )
称为拟卤素,性质与卤素相似.下列说法不正确的是( )
M | N | ||
X | Y |
A.X位于三周期IIA,其单质可采用电解熔融![]() 制备
制备
B.元素最高价氧化物的水化物中,酸性最强的是![]()
C.气体分子![]() 的电子式为
的电子式为![]()
D.![]() 其与氢氧化钠溶液反应的化学方程式为
其与氢氧化钠溶液反应的化学方程式为![]()