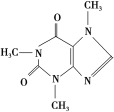
题目内容
【题目】现代传感信息技术在化学实验中有广泛的应用。某小组用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理(如图1所示),并测定电离平衡常数Kb。
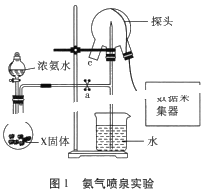
(1)实验室可用浓氨水和X固体制取NH3,X固体不可以是___;
A.五氧化二磷 B.生石灰 C.碱石灰 D.无水氯化钙
(2)检验三颈瓶集满NH3的方法是___。
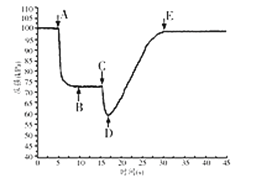
(3)关闭a,将带有装满水的胶头滴管的橡皮塞塞紧c口,___,引发喷泉实验,电脑绘制三颈瓶内气压变化曲线如图2所示。图2中___点时喷泉最剧烈。
(4)从三颈瓶中用___(填仪器名称)量取20.00mL氨水至锥形瓶中,用0.05000mol/LHC1滴定。用pH计采集数据、电脑绘制滴定曲线如图3所示。
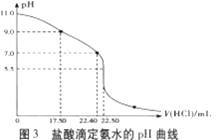
(5)据图3计算,当pH=11.0时,NH3·H2O电离平衡常数Kb近似值,Kb≈___。
【答案】AD 将湿润的红色石蕊试纸靠近瓶口c,试纸变蓝色,证明NH3已收满;或:将蘸有浓盐酸的玻璃棒靠近瓶口c,有白烟生成,证明NH3已收满; 打开b,挤压胶头滴管使水进入烧瓶 C 碱式滴定管 1.8×10-5
【解析】
(1)浓氨水易挥发,生石灰、碱石灰溶于水与水反应放出大量的热,能够促进氨气的逸出,而无水氯化钙、五氧化二磷都能够与氨气反应,所以不能用来制氨气;
(2)因为氨气和水反应生成一水合氨,一水合氨电离出氢氧根离子而导致氨水溶液呈碱性,红色石蕊试液遇碱蓝色,氨气也能和HCl反应生成白烟,所以检验氨气的方法可以用湿润的红色石蕊试纸或者用蘸有浓盐酸的玻璃棒;
(3)要形成喷泉实验,应使瓶内压强小于外界压强,形成压强差;
(4)氨水显碱性,量取碱性溶液,应选择碱式滴定管;
(5)利用中和酸碱滴定的图像,判断滴定终点,计算出氨水中一水合氨的物质的量浓度,结合滴定前溶液的pH,计算一水合氨的电离平衡常数。
(1)A.五氧化二磷是酸性干燥剂,能与氨气反应,A不能制取氨气;
B.浓氨水易挥发,生石灰溶于水与水反应放出大量的热,能够促进氨气的逸出,B正确;
C.浓氨水易挥发,碱石灰溶于水与水反应放出大量的热,能够促进氨气的逸出,C正确;
D.无水氯化钙能够与氨气反应,不能用来制氨气,D错误;
答案选AD。
(2)氨气和水反应生成一水合氨,一水合氨电离出氢氧根离子而导致氨水溶液呈碱性,红色石蕊试液遇碱蓝色,氨气也能和HCl反应生成白烟,所以氨气的检验方法为:将湿润的红色石蕊试纸靠近瓶口c,试纸变蓝色,证明NH3已收满;或:将蘸有浓盐酸的玻璃棒靠近瓶口c,有白烟生成,证明NH3已收满;
(3)要形成喷泉实验,应使瓶内外形成负压差,而氨气极易溶于水,所以打开b,挤压胶头滴管使水进入烧瓶,氨气溶于水,使瓶内压强降低,形成喷泉;三颈瓶内气体与外界大气压压强之差越大,其反应速率越快,C点压强最小、大气压不变,所以大气压和C点压强差最大,则喷泉越剧烈,
故答案为:打开b,挤压胶头滴管使水进入烧瓶;C;
(4)氨水显碱性,量取碱性溶液,应选择碱式滴定管;
故答案为:碱式滴定管;
(5)设氨水中NH3H2O的物质的量浓度为c,则:c×20mL=0.05000mol/L×22.40mL,解得c=0.056mol/L,弱电解质电离平衡常数Kb= ![]() ,pH=11的氨水中c(OH-)=
,pH=11的氨水中c(OH-)=
0.001mol/L,c(OH-)≈c(NH4+)=0.001mol/L,则:Kb= ![]() =1.8×10-5;
=1.8×10-5;
故答案为:1.8×10-5。

 初中暑期衔接系列答案
初中暑期衔接系列答案