题目内容
8. (1)化学镀的原理是利用化学反应生成金属单质沉积在镀件表面形成镀层.
(1)化学镀的原理是利用化学反应生成金属单质沉积在镀件表面形成镀层.①若用铜盐进行化学镀铜,应选用还原剂(填“氧化剂”或“还原剂”)与之反应.
②某化学镀铜的反应速率随镀液pH变化如图所示.该镀铜过程中,镀液pH控制在12.5左右.据图中信息,给出使反应停止的方法:调节溶液的pH至8-9 之间.
(2)酸浸法制取硫酸铜的流程示意图如下

①步骤(ii)所加试剂起调节pH作用的离子是HCO3-(填离子符号).
②在步骤(iii)发生的反应中,1mol MnO2转移2mol电子,该反应的离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O.
③步骤(iv)除去杂质的化学方程式可表示为:3Fe3++NH4++2SO42-+6H2O=NH4Fe3(SO4)2(OH)6↓+6H+
过滤后母液的pH=2.0,c(Fe3+)=a mol•L-1,c(NH4+)=b mol•L-1,c(SO42-)=d mol•L-1,该反应的平衡常数K=$\frac{1{0}^{-12}}{{a}^{3}b{d}^{2}}$(用含a、b、d 的代数式表示).
分析 (1)①要把铜从铜盐中置换铜出来,比如用铁就可以,铁是作还原剂的,所以加入还原剂;
②根据图示信息,pH=8-9之间,反应速率为0,所以要使反应停止,调节溶液的pH至8-9 之间;
(2)①加入的碳酸氢铵目的是调高pH,碳酸氢根离子能与溶液中氢离子反应;
②由题意可知,亚铁离子变成了铁离子,1mol MnO2转移电子2 mol,则锰元素从+4变成+2价,溶液是显酸性,反应还有水生成,配平书写离子方程式;
③代入平衡常数表达式K=$\frac{{c}^{6}({H}^{+})}{{c}^{3}(F{e}^{3+})×c(N{{H}_{4}}^{+})×{c}^{2}(S{{O}_{4}}^{2-})}$计算.
解答 解:(1)①要把铜从铜盐中置换铜出来,比如用铁就可以,铁是作还原剂的,所以加入还原剂,故答案为:还原剂;
②根据图示信息,pH=8-9之间,反应速率为0,所以要使反应停止,调节溶液的pH至8-9 之间,故答案为:调节溶液的pH至8-9 之间;
(2)①加入的碳酸氢铵目的是调高pH,碳酸氢根离子能与溶液中氢离子反应,使溶液pH增大,故答案为:HCO3-;
②由题意可知,亚铁离子变成了铁离子,1mol MnO2转移电子2 mol,则锰元素从+4变成+2价,溶液是显酸性,反应还有水生成,反应离子方程式为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,
故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
③除去杂质的化学方程式可表示为:3Fe3++NH4++2SO42-+6H2O=NH4Fe3 (SO4)2(OH)6+6H+,过滤后母液的pH=2.0,c(Fe3+)=a mol•L-1,c( NH4+)=b mol•L-1,c( SO42-)=d mol•L-1,氢离子浓度为10-2,代入平衡常数表达式K=$\frac{{c}^{6}({H}^{+})}{{c}^{3}(F{e}^{3+})×c(N{{H}_{4}}^{+})×{c}^{2}(S{{O}_{4}}^{2-})}$=$\frac{(1{0}^{-2})^{6}}{{a}^{3}×b×{d}^{2}}$=$\frac{1{0}^{-12}}{{a}^{3}b{d}^{2}}$,
故答案为:$\frac{1{0}^{-12}}{{a}^{3}b{d}^{2}}$.
点评 本题考查实验制备方案、化学工艺流程、对操作与试剂的分析评价、方程式书写、平衡常数计算、电镀等,侧重考查学生的分析能力,题目难度中等.

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案| A. | 1L溶液中所含阴阳离子总数是1.5NA个 | |
| B. | 1L溶液中含0.5NA个NO3- | |
| C. | 500 mL溶液中Ba2+的浓度是0.5 mol/L | |
| D. | 500mL溶液中含0.5NA个NO3- |
| A. | 20% | B. | 75% | C. | 25% | D. | 66% |
| A. | 向Na2CO3饱和溶液中,通入过量的CO2后,在减压、加热的条件下,蒸发得NaHCO3晶体 | |
| B. | 加热蒸发AlCl3饱和溶液得纯净的AlCl3晶体 | |
| C. | 向FeBr2溶液中加入过量的氯水,加热蒸发得FeCl3晶体 | |
| D. | 向FeCl3溶液里加入足量NaOH溶液,经过滤、洗涤沉淀,再充分灼烧沉淀得Fe2O3 |
 的有机物,下列关于它的说法不正确的是( )
的有机物,下列关于它的说法不正确的是( )| A. | 分子式为C10H16 | B. | 其一氯代物有8种 | ||
| C. | 能与溴水发生加成反应 | D. | 难溶于水,且密度比水大 |
| A. | 氢氧化钡溶液中滴加硫酸氢钠至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| B. | 饱和碳酸钠溶液中通入二氧化碳后溶液变浑浊:2Na++CO32-+CO2+H2O=2NaHCO3↓ | |
| C. | 碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-=CO32-+H2O | |
| D. | 5.6g Fe与200mL2.0mol/L HNO3溶液充分反应:3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O |
(1)C的离子结构示意图
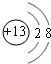 E在周期表中的位置第三周期第VIIA族
E在周期表中的位置第三周期第VIIA族(2)A与氢元素组成的化合物分子甲中含有8个原子,与D同主族的某元素与氢组成的化合物乙与甲的电子数相等,则乙的电子式为
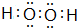
(3)B的最简单气态氢化物丙的水溶液显碱性
①在微电子工业中丙的水溶液与乙反应的产物不污染环境,其相互反应的化学方程式为2NH3•H2O+3H2O2=N2↑+8H2O
②一定条件下,丙在固定体积的密闭容器中分解(△H>0)并到达平衡,仅改变下列条件X平衡体系中随X递增Y递减的是ab
| 选项 | a | b | c | d |
| X | 温度 | 加入氢气 | 加入丙 | 温度 |
| Y | n(丙) | 丙的转化率 | n(生成物) | n(H2) |
(5)A与D形成的液态化合物AD20.2mol在O2中完全燃烧,生成两种稳定的气态氧化物,在298K时放出热量215kJ写出表示该化合物燃烧热的热化学方程式:CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ/mol.