题目内容
16. 某温度下,向10mL0.1mol/LCuCl2溶液中滴加0.1mol/L的Na2S溶液,滴加过程中溶液中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是已知:lg2=0.3,Ksp(ZnS)=3×10-25mol2/L2.( )
某温度下,向10mL0.1mol/LCuCl2溶液中滴加0.1mol/L的Na2S溶液,滴加过程中溶液中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是已知:lg2=0.3,Ksp(ZnS)=3×10-25mol2/L2.( )| A. | a、b、c三点中,水的电离程度最大的为b点 | |
| B. | Na2S溶液中:c(S2-)+c(HS-)+c(H2S)═2c(Na+) | |
| C. | 该温度下Ksp(CuS)=4×10-36 mol2/L2 | |
| D. | 向100 mLZn2+、Cu2+浓度均为10-5mol/L的混合溶液中逐滴加入10-4mol/L的Na2S溶液,Zn2+先沉淀 |
分析 向10mL0.1mol/LCuCl2溶液中滴加0.1mol/L的Na2S溶液,发生反应:Cu2++S2-?CuS↓,Cu2+单独存在或S2-单独存在均会水解,水解促进水的电离,结合图象计算溶度积常数和溶液中的守恒思想,据此判断分析.
解答 解:向10mL0.1mol/LCuCl2溶液中滴加0.1mol/L的Na2S溶液,发生反应:Cu2++S2-?CuS↓,Cu2+单独存在或S2-单独存在均会水解,水解促进水的电离,b点溶液时滴加Na2S溶液的体积是20mL,此时恰好生成CuS沉淀,CuS存在沉淀溶解平衡:CuS(s)?Cu2+(aq)+S2-(aq),已知此时-lgc(Cu2+)=17.7,则平衡时c(Cu2+)=c(S2-)=10-17.7mol/L,
A.Cu2+单独存在或S2-单独存在均会水解,水解促进水的电离,b点时恰好形成CuS沉淀,此时水的电离程度并不是a,b,c三点中最大的,故A错误;
B.Na2S溶液中,根据物料守恒,2c(S2-)+2c(HS-)+2c(H2S)═c(Na+),故B错误;
C.该温度下,平衡时c(Cu2+)=c(S2-)=10-17.7mol/L,则Ksp(CuS)=c(Cu2+)c(S2-)=10-17.7mol/L×10-17.7mol/L=10-35.4mol2/L2,由于已知lg2=0.3,则Ksp(CuS)=10-35.4mol2/L2=(100.3)2×10-36mol2/L2=4×10-36 mol2/L2,故C正确;
D.向100 mLZn2+、Cu2+浓度均为10-5mol/L的混合溶液中逐滴加入10-4mol/L的Na2S溶液,产生ZnS时需要的S2-浓度为c(S2-)=$\frac{{K}_{sp}(ZnS)}{c(Z{n}^{2+})}$=$\frac{3×1{0}^{-25}mo{l}^{2}/{L}^{2}}{1{0}^{-5}mol/L}$=3×10-20mol/L,产生CuS时需要的S2-浓度为c(S2-)=$\frac{{K}_{sp}(CuS)}{c(C{u}^{2+})}$=$\frac{4×1{0}^{-36}mo{l}^{2}/{L}^{2}}{1{0}^{-5}mol/L}$=4×10-31mol/L,则产生CuS沉淀所需S2-浓度更小,优先产生CuS沉淀,故D错误.
故选C.
点评 本题考查沉淀溶解平衡知识,根据图象所提供的信息计算出CuS的Ksp数值是关键,对于同类型的沉淀可直接根据Ksp数值比较溶解性情况,不同类型的沉淀则需要定量计算比较,这是易错点,题目难度中等,注意守恒思想的运用.

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案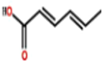
| A. | 该有机物与等物质的量Br2发生加成反应时,可生成两种加成产物 | |
| B. | 该有机物能与金属Na、NaOH溶液、Na2CO3溶液、NaHCO3溶液发生反应 | |
| C. | 该有机物能发生加成、取代、氧化、消去、加聚反应 | |
| D. | 可使用酸性高锰酸钾溶液鉴别该有机物和乳酸(2-羟基丙酸) |
| A. | N3-与CO2 | B. | BF3和C O32- | C. | NO2+与CO2 | D. | H3O+与NH3 |
| A. | 电解质与非电解质的本质区别,是在水溶液或熔化状态下能否电离 | |
| B. | SO2水溶液能导电性,SO2是电解质,BaSO4水溶液不导电是非电解质 | |
| C. | 酸、碱和盐类都属于电解质,其他化合物都是非电解质 | |
| D. | Cu能导电所以Cu是电解质 |
| A. | CO2 和 H2O | B. | CO 和 CH3OH | C. | CH3OH 和 H2 | D. | H2 和 CO2 |
| A. | 极性键 | B. | 非极性键 | C. | 配位键 | D. | σ键 | ||||
| E. | π键 | F. | 离子键. |
| A. |  蒸发 | B. |  过滤 | ||
| C. |  蒸馏 | D. |  分液 |
| A. | CH3-CH═CH-CH3 | B. |  | ||
| C. | HOCH2-CH2-CH═CH-CH3 | D. | CH3CH2CH2Cl |
