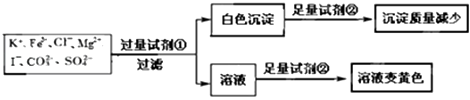
��Ŀ����
����Ŀ�����ֶ�����Ԫ��A��B��C��D��E��F��ԭ��������������A��Cͬ�壬B��D ͬ�壬C���Ӻ�B���Ӿ�����ͬ�ĵ��Ӳ�ṹ��A��B��D��E��F�����γɹ��ۻ����A��B�γɵĻ�������ˮ�гʼ��ԡ��ش��������⣺
��1������Ԫ���У�ԭ�Ӱ뾶����Ԫ�������ڱ��е�λ�ã� �� �ǽ�������ǿ��Ԫ����ԭ�ӽṹʾ��ͼΪ����
��2����˵��E��F�ǽ�����ǿ������ʵ������һ����ѧ����ʽ��������
��3���õ���ʽ��ʾC��EԪ����ɵĻ�������γɹ��̣� ��
��4����A��B��D��E��F���γɵĹ��ۻ������У����ȶ���������(�û�ѧʽ��ʾ)��
��5��D�ڲ������F��ȼ�գ����ɵ���Ҫ����ĽṹʽΪ��
��6��A��F�γɵĻ�������A��B�γɵĻ����ﷴӦ������ĵ���ʽΪ �� ���д��ڵĻ�ѧ������Ϊ��
��7��д��F��ͬ���������Ԫ�صĵ�����ˮ��Ӧ�Ļ�ѧ����ʽ��
���𰸡�
��1���������� �ڢ�A�壻
��2��H2S+Cl2=2HCl+S
��3��![]()
��4��PH3
��5��
��6��![]() �����Ӽ����ۼ�
�����Ӽ����ۼ�
��7��2F2+2H2O=4HF+O2
����������1�����Ӳ�Խ�ࡢԭ�Ӱ뾶Խ���Ӳ���ͬʱ���˵����ԽС��ԭ�Ӱ뾶Խ��������Ԫ���У�Naԭ�Ӱ�������λ�ڵ�һ���ڵڢ�A��ͬһ�����У�ԭ������Խ�ǽ�����Խǿ����Cl�ķǽ�������ǿ��ԭ�ӽṹʾ��ͼΪ  ��
��
��2�������ܰ�H2S�е�S�û�������˵���ǽ�������Cl��S������ʽΪH2S+Cl2��2HCl+S��
��3�����������ӻ�������γɹ��̿ɱ�ʾΪ ![]() ��
��
��4���ǽ�����Cl��P��N��P�������ȶ���������ΪPH3��
��5��P��������������ȼ���������Ȼ��ף��ṹʽΪ  ��
��
��6��HCl�백����Ӧ�����Ȼ�泥���ѧʽΪNH4Cl���Ȼ���������ӻ��������ʽΪ  ���仯ѧʽ�д������Ӽ������ۼ���
���仯ѧʽ�д������Ӽ������ۼ���
��7��F�ĵ���Ϊ��������ˮ��Ӧ����HF����������Ӧ�ķ���ʽΪ2F2+2H2O��4HF+O2��
���Դ��ǣ���1���������� �ڢ�A�壻 ����2��H2S+Cl2==2HCl+S����3��
����2��H2S+Cl2==2HCl+S����3��![]() ����4��PH3����5��
����4��PH3����5�� ����6��
����6��![]() �����Ӽ����ۼ�����7��2F2+2H2O=4HF+O2��
�����Ӽ����ۼ�����7��2F2+2H2O=4HF+O2��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�