题目内容
12.下列有关双氧水说法错误的是( )| A. | H2O2、Na2O2都属于过氧化物,都存在非极性共价键 | |
| B. | 1mol H2O2在参加反应时可能转移lmol或2mol电子 | |
| C. | H2O2在酶作用下催化分解,随着温度的升高,分解速率持续加快 | |
| D. | H2O2做漂白剂是利用其氧化性,漂白原理与HClO类似、与SO2不同 |
分析 H2O2、Na2O2都属于过氧化物,含有O-O键,为非极性键,二者都具有强氧化性,可用于漂白,为氧化剂时,O元素化合价由-1价变化为-2价,另外双氧水在高温下分解,过氧化氢可使但蛋白质变性,以此解答该题.
解答 解:A.H2O2、Na2O2都属于过氧化物,过氧根离子中的氧原子和氧原子之间是共价键,故A正确;
B.1mol H2O2在参加反应时,如自身发生氧化还原反应,则转移1mol电子,如被还原生成水,则转移2mol电子,故B正确;
C.酶为蛋白质,如温度较高,则蛋白质发生变形,且过氧化氢可使蛋白质发生变形,不能用酶催化蛋白质,故C错误;
D.过氧化氢具有氧化性,可用于漂白,与HClO相似,但与二氧化硫不同,二氧化硫与有色物质发生化学反应,故D正确.
故选C.
点评 本题综合考查元素化合物知识,为高频考点,侧重于学生的分析能力以及双基的考查,主要把握过氧化氢的性质,难度不大,易错点为C,主要过氧化氢可使蛋白质变性的特点.

练习册系列答案
相关题目
7.下列说法正确的是( )
| A. | 明矾净水过程中不涉及化学变化 | B. | 金属与盐溶液反应都是置换反应 | ||
| C. | 化合反应一定有单质参加反应 | D. | 石油分馏和碘的升华都是物理变化 |
17.下列物质中属于碱性氧化物的是( )
| A. | SO2 | B. | CaO | C. | CO | D. | NaOH |
4.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 2.0g H218O与D2O的混合物中所含中子数为NA | |
| B. | 常温常压下,60g丙醇中存在的共价键总数为10NA | |
| C. | 1 molCu和足量热浓硫酸反应可生成NA个SO3分子 | |
| D. | 标准状况下,2.24L三氯甲烷中含有C-Cl键数目为0.3NA |
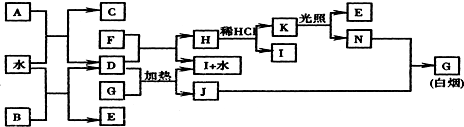
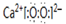 ;K的结构式是H-O-Cl.
;K的结构式是H-O-Cl.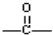
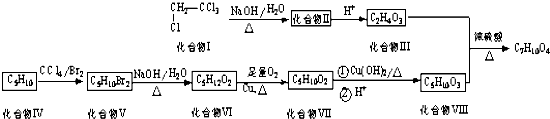
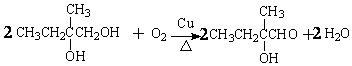 .
.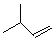 ,该六元环酯(C7H10O4)的结构简式为
,该六元环酯(C7H10O4)的结构简式为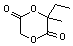 .
.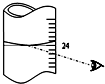 叠氮化钠(NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起.实验室测定叠氮化钠样品中NaN3的质量分数.
叠氮化钠(NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起.实验室测定叠氮化钠样品中NaN3的质量分数.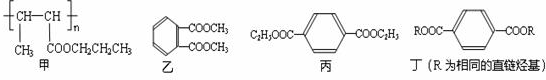
 .
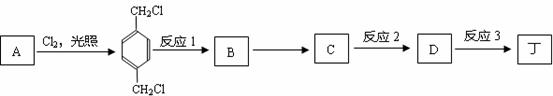
.
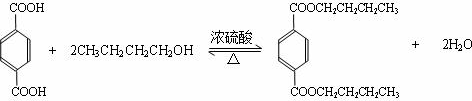 .
.