题目内容
【题目】对于反应A(g)+3B(g)![]() 2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
A.v(A)=0.01mol/(L·s)B.v(B)=0.02mol/(L·s)
C.v(B)=0.60mol/(L·min)D.v(C)=1.00mol/(L·min)
【答案】A
【解析】
A. v(A)=0.01mol/(L·s)转化为v(B)=1.8 mol/(L·min);
B. v(B)=0.02mol/(L·s)换算单位v(B)=1.2 mol/(L·min);
C. v(B)=0.60mol/(L·min)
D. v(C)=1.00mol/(L·min) 转化为v(B)=1.5 mol/(L·min);
反应速率最快的为1.8 mol/(L·min),答案为A。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案【题目】已知部分弱酸的电离平衡常数如表:
弱酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
电离平衡常数(25℃) | Ka=1.75×10-5 | Ka=2.98×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
下列离子方程式正确的是( )
A.少量CO2通入NaClO溶液中:CO2+H2O+2ClO-═CO![]() +2HClO
+2HClO
B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO
C.少量SO2通入Na2CO3溶液中:SO2+H2O+2CO![]() ═SO
═SO![]() +2HCO
+2HCO![]()
D.相同浓度NaHCO3溶液与醋酸溶液等体积混合:H++HCO![]() ═CO2↑+H2O
═CO2↑+H2O
【题目】五氧化二钒![]() 在冶金、化工等领域有重要应用。实验室以含钒废料
在冶金、化工等领域有重要应用。实验室以含钒废料![]() 含
含![]() 、CuO、MnO、
、CuO、MnO、![]() 、
、![]() 、有机物
、有机物![]() 为原料制备
为原料制备![]() 的一种流程如下:
的一种流程如下:

已知:![]() 时,难溶电解质的溶度积常数如表所示:
时,难溶电解质的溶度积常数如表所示:
难溶电解质 |
|
|
|
|
|
|
|
(1)“焙烧”的目的是____________________________________________;
(2)“滤渣1”的用途为____________![]() 写出一种即可
写出一种即可![]() ;常温下,若“调pH”为7,
;常温下,若“调pH”为7,![]() 是否能沉淀完全:______
是否能沉淀完全:______![]() 填“是”或“否”
填“是”或“否”![]() ;
;![]() 溶液中离子浓度小于
溶液中离子浓度小于![]() 时,认为该离子沉淀完全
时,认为该离子沉淀完全![]()
(3)“沉锰”需将温度控制在![]() 左右,温度不能过高或过低的原因为_______________;
左右,温度不能过高或过低的原因为_______________;
(4)结晶所得的![]() 需进行水洗、干燥。证明
需进行水洗、干燥。证明![]() 已洗涤干净的实验操作及现象为_______________________;
已洗涤干净的实验操作及现象为_______________________;
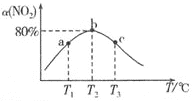
(5)在煅烧![]() 生成
生成![]() 的过程中,固体残留率
的过程中,固体残留率![]() 随温度变化的曲线如图所示。其分解过程中先后失去的物质分别是_________、____________。
随温度变化的曲线如图所示。其分解过程中先后失去的物质分别是_________、____________。![]() 填写分子式
填写分子式![]()
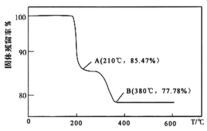
(6)为测定该产品的纯度,兴趣小组同学准确称取![]() 产品
产品![]() ,加入足量稀硫酸使其完全反应,生成
,加入足量稀硫酸使其完全反应,生成![]() ,并配成
,并配成![]() 溶液。取
溶液。取![]() 溶液用
溶液用![]() 的
的![]() 标准溶液滴定,滴定到终点时消耗标准液
标准溶液滴定,滴定到终点时消耗标准液![]() 。已知滴定过程中
。已知滴定过程中![]() 被氧化为
被氧化为![]() ,
,![]() 黄色
黄色![]() 被还原为
被还原为![]() 蓝色
蓝色![]() ,该反应的离子方程式为_____________;该产品的纯度为_________________。
,该反应的离子方程式为_____________;该产品的纯度为_________________。