题目内容
11.下列关于物质的量浓度表述中正确的是( )| A. | 0.3 mol•L-1 Na2SO4溶液中含有Na+和SO42-总物质的量为0.9 mol | |
| B. | 当1 L水吸收22.4 L氨气时所得氨水的浓度不是1 mol•L-1,只有当22.4 L氨气溶于水制得1 L氨水时,其浓度才是1 mol•L-1 | |
| C. | 在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量浓度相等,则K+和Cl-的物质的量浓度一定相同 | |
| D. | 10℃时0.35 mol•L-1的KCl饱和溶液100 mL,蒸发掉5 g水,冷却到10℃时,其体积小于100 mL,它的物质的量浓度仍为0.35 mol•L-1 |
分析 A.缺少溶液体积,无法计算溶液中钠离子和硫酸根离子的物质的量;
B.没有告诉在标况下,不能使用标况下的气体摩尔体积计算氨气的物质的量;
C.钾离子的浓度是硫酸根的2倍,钠离子和氯离子浓度相等,如果Na+和SO42-的物质的量浓度相等,则K+是Cl-的物质的量浓度的2倍;
D.饱和溶液中溶质的物质的量浓度不变.
解答 解:A.没有告诉硫酸钠溶液的体积,无法计算溶液中钠离子和硫酸根离子的物质的量之和,故A错误;
B.不是标况下,题中条件无法计算22.4L氨气的物质的量,则无法计算该溶液的物质的量浓度,故B错误;
C.硫酸钾中,钾离子浓度是硫酸根浓度的2倍,NaCl中钠离子等于氯离子浓度,由于Na+和SO42-的物质的量浓度相等,故K+是Cl-的物质的量浓度的2倍,故C错误;
D.10℃时0.35 mol•L-1的KCl饱和溶液100 mL,蒸发掉5 g水,冷却到10℃时,其体积小于100 mL,但是此时仍然为饱和溶液,则它的物质的量浓度仍为0.35 mol•L-1,故D正确;
故选D.
点评 本题考查了物质的量浓度的计算与判断,题目难度中等,明确物质的量浓度的概念及表达式为解答关键,试题侧重考查学生的分析能力及灵活应用能力.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
1.研究人员研制利用低品位软锰矿浆(主要成分是MnO2)吸收硫酸厂的尾气SO2,制备硫酸锰的生产流程如下:
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、
Pb2+等其他金属离子.PbO2的氧化性大于MnO2.
有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见如图.
请回答下列问题:
(1)写出浸出过程中生成Mn2+反应的化学方程式SO2+MnO2=MnSO4,
(2)氧化过程中主要反应的离子方程式2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
(3)在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至4.7≤pH<8.3范围.
(4)阳离子吸附剂可用于除去杂质金属离子.请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有吸附时间、金属离子半径、金属离子电荷等.吸附步骤除去的主要离子为:Pb2+、Ca2+.
(5)电解MnSO4和ZnSO4的混合溶液可制备MnO2和Zn,写出阳极的电极反应方程式Mn2+-2e-+2H2O=MnO2↓+4H+.

已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、
Pb2+等其他金属离子.PbO2的氧化性大于MnO2.
有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见如图.

| 离子 | 离子半径(pm) | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 | - | - |
(1)写出浸出过程中生成Mn2+反应的化学方程式SO2+MnO2=MnSO4,
(2)氧化过程中主要反应的离子方程式2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
(3)在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至4.7≤pH<8.3范围.
(4)阳离子吸附剂可用于除去杂质金属离子.请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有吸附时间、金属离子半径、金属离子电荷等.吸附步骤除去的主要离子为:Pb2+、Ca2+.
(5)电解MnSO4和ZnSO4的混合溶液可制备MnO2和Zn,写出阳极的电极反应方程式Mn2+-2e-+2H2O=MnO2↓+4H+.
16.化合物 在核磁共振氢谱图中各信号的面积比为( )
在核磁共振氢谱图中各信号的面积比为( )
 在核磁共振氢谱图中各信号的面积比为( )
在核磁共振氢谱图中各信号的面积比为( )| A. | 3:2:2:1:6 | B. | 3:4:1:3:3 | C. | 9:4:1 | D. | 3:4:7 |
 某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.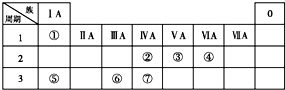 下表为元素周期表的一部分,请参照①~⑦相关元素在表中的位置,用化学用语回答下列问题:
下表为元素周期表的一部分,请参照①~⑦相关元素在表中的位置,用化学用语回答下列问题: .
.