题目内容
5.近几年来关于氮污染的治理倍受关注.(1)三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的CO、CxHy、NOx三种成分的净化,其催化剂表面物质转化的关系如图1所示,化合物X中含有NO3-
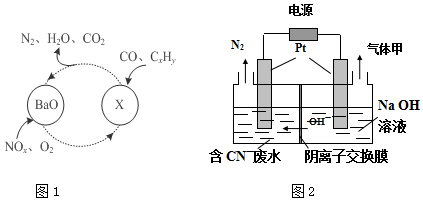
②①在图示的转化中,被还原的元素是N、O,X的化学式为Ba(NO3)2.
某新技术(SCR技术)可使NOx与NH3的直接反应,实现无害转化.当NO与NO2的物质的量之比为4:1时,写出发生反应的化学方程式8NH3+8NO+2NO2=9N2+12H2O.
(2)利用NH3的还原性可消除氮氧化物的污染,相关热化学方程式如下:
H2O(l)=H2O(g)△H1=+44.0kJ•mol-1
N2(g)+O2(g)=2NO(g)△H2=+229.3kJ•mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H3=-906.5kJ•mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(l)△H4 则△H4=-2317.0 kJ•mol-1
(3)加入过量次氯酸钠可使废水中NH4+ 完全转化为N2,而本身被还原为NaCl.
①写出上述反应的离子方程式:2NH4++3ClO-=N2↑+3Cl-+2H++3H2O.
②若处理废水产生了0.448L N2(标准状况),则需消耗浓度为0.5mol•L-1的次氯酸钠的体积为120mL.
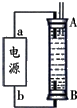
(4)某工业废水中含有毒性较大的CN-,可用电解法将其转变为N2,装置如图2所示.气体甲是H2(写化学式),电解池中生成N2的电极反应式为2CN-+12OH--10e-=2CO32-+N2↑+6H2O.
分析 (1)根据化合价降低为氧化剂被还原判断;氮的氧化物与BaO结合生成Ba(NO3)2;
根据NOx与NH3的直接反应,实现无害转化,则生成氮气和水,据此书写方程式;
(2)H2O(l)=H2O(g)△H1=44.0kJ•mol-1 (i)
N2(g)+O2(g)=2NO(g)△H2=229.3kJ•mol-1 (ii)
4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H3=-906.5kJ•mol-1 (iii)
由盖斯定律可知(iii)-(ii)×5-(i)×6得:4NH3(g)+6NO(g)=5N2(g)+6H2O(l);
(3)①根据次氯酸钠氧化废水中NH4+ 完全转化为N2,而本身被还原为NaCl结合得失电子守恒配平方程式;
②根据反应的离子方程式进行计算;
(4)由装置如图3所示,左边为阳极为CN-失电子生成氮气的反应,右边为阴极为氢离子得电子生成氢气的反应,据此分析.
解答 解:(1)在图1所示的转化中N、O化合价降低为氧化剂被还原;氮的氧化物与BaO结合生成Ba(NO3)2,所以X为Ba(NO3)2;因为NOx与NH3的直接反应,实现无害转化,则生成氮气和水,所以当NO与NO2的物质的量之比为4:1时,发生反应的化学方程式为8NH3+8NO+2NO2=9N2+12H2O;
故答案为:N、O;Ba(NO3)2;8NH3+8NO+2NO2=9N2+12H2O;
(2)H2O(l)=H2O(g)△H1=44.0kJ•mol-1 (i)
N2(g)+O2(g)=2NO(g)△H2=229.3kJ•mol-1 (ii)
4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H3=-906.5kJ•mol-1 (iii)
(iii)-(ii)×5-(i)×6得:4NH3(g)+6NO(g)=5N2(g)+6H2O(l),故△H4=-906.5-(229.3×5)-(44×6)=-2317.0 kJ•mol-1,
故答案为:-2317.0 kJ•mol-1;
(3)①因为次氯酸钠氧化废水中NH4+ 完全转化为N2,而本身被还原为NaCl,根据得失电子守恒,离子方程式为2NH4++3ClO-=N2↑+3Cl-+2H++3H2O,
故答案为:2NH4++3ClO-=N2↑+3Cl-+2H++3H2O;
②由2NH4++3ClO-=N2↑+3Cl-+2H++3H2O得,处理废水产生了0.448L即$\frac{0.448L}{22.4L/mol}$=0.02mol N2(标准状况),则需消耗浓度为0.5mol•L-1的次氯酸钠的体积为$\frac{0.02×3}{0.5}$×1000ml=120ml,
故答案为:120;
(4)由装置如图3所示,左边为阳极为CN-失电子生成氮气的反应,又溶液成碱性,所以反应式为:2CN-+12OH--10e-=2CO32-+N2↑+6H2O;右边为阴极为氢离子得电子生成氢气的反应,所以甲为氢气,
故答案为:H2;2CN-+12OH--10e-=2CO32-+N2↑+6H2O.
点评 本题考查了氧化还原反应、盖斯定律的应用、电解池的原理的应用,题目难度中等,明确盖斯定律的应用方法以及从化合价的角度分析氧化还原反应是解题的关键,侧重于考查学生的分析能力、计算能力和对基础知识的综合应用能力.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案| A. | F- | B. | Cl- | C. | Na+ | D. | NH2- |
| A. | 同温、同压下,相同体积的氮气和氦气所含的原子数相等 | |
| B. | 标准状况下,5.6 L以任意比例混合的氯气和氧气所含的原子数为0.5NA | |
| C. | 1 mol氯气和足量NaOH溶液反应转移的电子数为2NA | |
| D. | 常温常压下,22.4 L的NO2和CO2混合气体含有2NA个O原子 |
 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ/mol
C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJ/mol
则CO还原Fe2O3的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO.PdCl2被还原成单质,反应的化学方程式为PdCl2+CO+H2O=Pd+CO2+2HCl;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2构成丙烷燃料电池.
①负极电极反应式是:C3H8+26OH--20e-=3CO32-+17H2O;
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是ABD(填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-=H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
②实验2中,平衡常数K=$\frac{1}{6}$;
③实验3跟实验2相比,改变的条件可能是使用了催化剂或增大了压强(答一种情况即可).
| A. | 0.5mol•L-1 | B. | 0.02mol•L-1 | C. | 0.25 mol•L-1 | D. | 0.05mol•L-1 |
| A. | 试管,烧杯 | B. | 烧瓶,烧杯 | C. | 试管,蒸发皿 | D. | 蒸发皿,量筒 |

 实验室制备溴苯可用如图所示装置.填空:
实验室制备溴苯可用如图所示装置.填空: .
.